Circ Res | 岳锐/徐大春/张力课题组合作揭示Fap调控心肌梗死修复新机制
急性心肌梗死是最常见的致死原因之一,目前急性心肌梗死的发病率仍居高不下,严重威胁人类健康。急性心肌梗死发生后,心脏成纤维细胞(Cardiac fibroblasts,CFs)是参与损伤修复的主要细胞类型之一,其中,成纤维细胞激活蛋白(Fibroblast activation protein,Fap)特异性标记了一群活化的CFs。作为一种丝氨酸蛋白酶,Fap在活化的成纤维细胞中显著上调,并在细胞外基质降解、肿瘤微环境形成、炎症和伤口愈合中发挥关键调控作用。然而在心肌梗死后Fap是否参与心脏损伤修复尚不清楚。既往研究表明,通过嵌合抗原受体T细胞免疫疗法(Chimeric Antigen Receptor T-Cell Immunotherapy,CAR-T)特异性清除心脏损伤后的Fap+ CFs可以显著改善心功能,并减少心肌纤维化1,2。值得关注的是,岳锐课题组的前期研究发现Fap在骨髓基质细胞和成骨细胞中同样高表达3,因此通过CAR-T疗法系统性清除此类细胞会导致严重的贫血、骨量减少、体重下降及恶病质状态4,5。
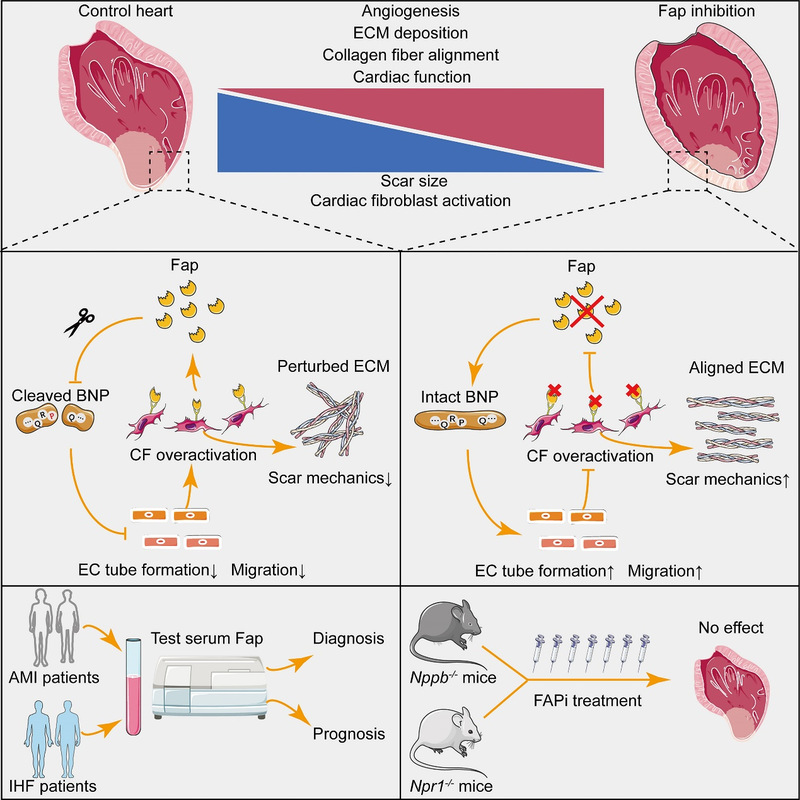
2023年2月9日,同济大学生命科学与技术学院、附属东方医院再生医学研究所岳锐课题组联合同济大学附属第十人民医院徐大春课题组、上海交通大学医学院附属新华医院张力课题组在国际著名期刊Circulation Research杂志(IF=23.2)在线发表了题为“Inhibition of Fap Promotes Cardiac Repair by Stabilizing BNP”的研究论文6。该研究系统阐明了Fap调控心肌梗死损伤修复的作用及分子机制,发现抑制Fap能够通过稳定脑利钠肽(Brain natriuretic peptide,BNP)蛋白水平促进血管新生和心脏修复,从而为该类疾病的临床诊断、预后和治疗提供了新思路与新靶点。

研究人员首先分析了肥厚性心肌病、缺血性心力衰竭病中Fap在心脏原位的表达情况,发现Fap在病理性心脏重构过程中原位表达明显上调。随后研究者收集了健康受试者、急性心肌梗死患者及缺血性心力衰竭患者的外周血液样本,通过ELISA及酶活性检测发现,在急性心肌梗死、缺血性心衰患者中,外周血Fap明显下调,且Fap下调的幅度与心脏的收缩功能、心脏缺血评分呈负相关。为了进一步研究Fap在心肌梗死后损伤修复过程中的作用,研究者利用基因敲除动物、药理学抑制模型发现,在心肌梗死后,抑制Fap可使得小鼠心功能得以保护,小鼠心肌梗死疤痕面积更小,梗死边缘区α-SMA+及Postn+的心脏成纤维细胞更少,提示成纤维细胞活化减少。与此同时,抑制Fap组小鼠心肌梗死边缘区血管生成增多,胶原纤维排列更整齐致密。提示Fap抑制后可促进小鼠心肌梗死后的损伤修复(图2)。
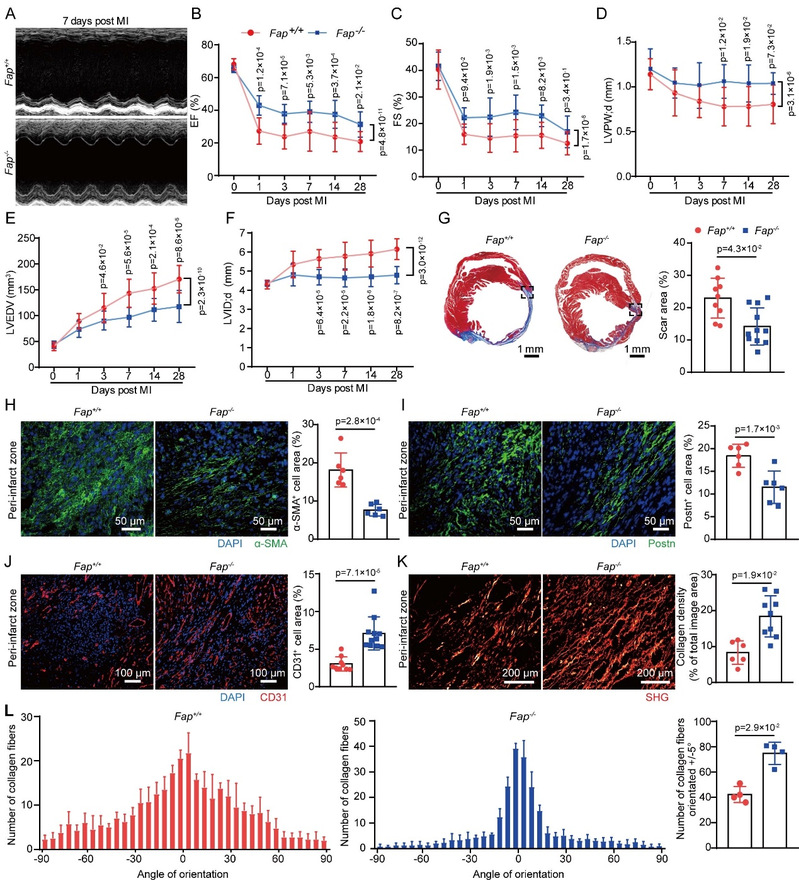
图2. 敲除Fap显著促进了心肌梗死后的心脏修复
随后研究者发现血管生成的增多同时伴随着成纤维细胞激活的减少。为进一步探讨心肌梗死后CFs与血管内皮细胞(Endothelial Cells,ECs)之间的相互作用,研究者利用3D水凝胶体系,将CFs与原代ECs进行共培养,结果发现在有ECs存在的情况下,CFs的活化下降,但细胞外基质(Extracellular Matrix,ECM)分泌能力提升。RNA-Seq结果表明,与CFs单独培养相比,ECs共培养后CFs具有更强的ECM分泌及促血管生成的能力,且细胞周期显著变慢(图3)。

图3. ECs促进CFs ECM沉积和排列,并防止其过度激活
为进一步阐明抑制Fap后促进心脏修复的具体分子机制,研究者对Fap敲除、Fap抑制剂治疗及野生型小鼠心肌梗死后梗死边缘区组织进行RNA-Seq,结果发现Fap敲除及抑制后可显著增强心肌收缩力、促进ECM在心肌梗死边缘区分泌及沉积,并显著上调HIF 1α、cGMP-PKG信号通路。BNP是激活cGMP-PKG信号通路的重要因子。研究者通过体外蛋白共孵育实验发现BNP可以被Fap切割降解,提示BNP是Fap潜在的酶切底物。随后的细胞实验证明,Fap可以抑制BNP促进ECs成管、迁移的生物学功能(图4)。为了进一步探索BNP是否为Fap的内源性底物,研究者在BNP或其受体(Npr1)敲除小鼠中敲除或抑制Fap,发现抑制Fap的心脏保护作用消失,表明BNP/Npr1-cGMP-PKG通路介导了抑制Fap后的心脏保护作用。
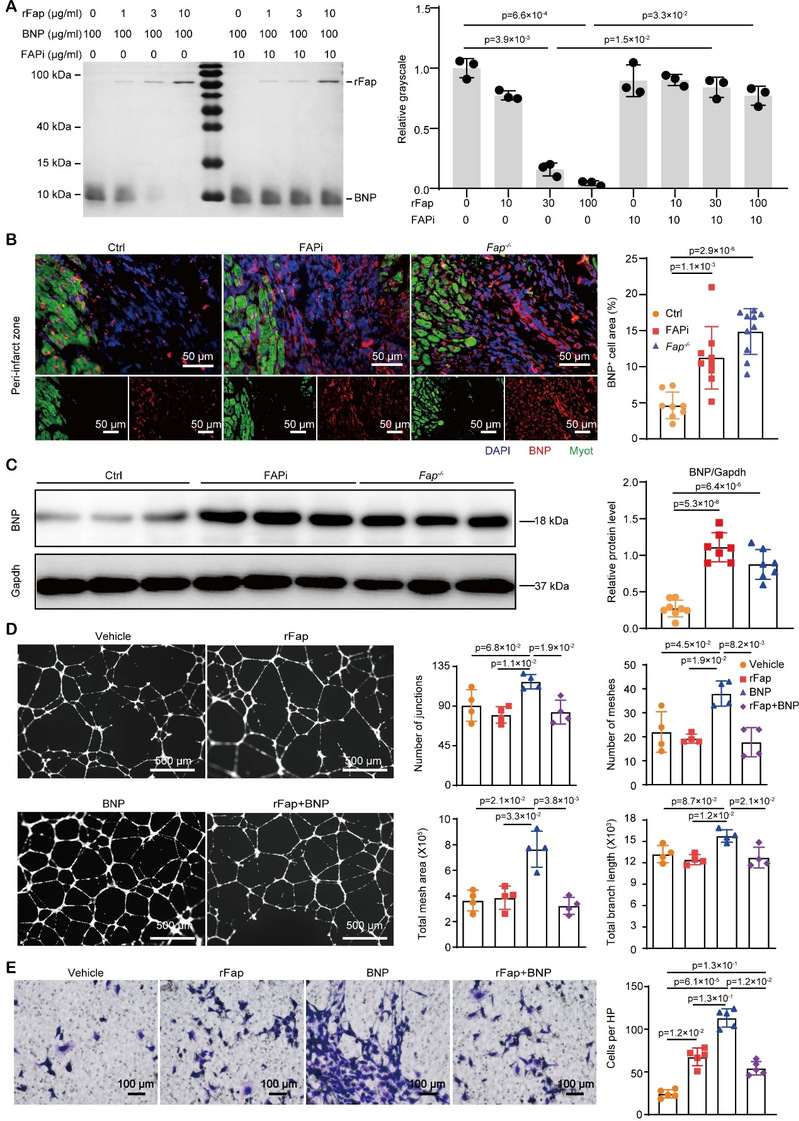
图4. Fap可以酶切降解BNP并抑制其促血管新生作用
综上所述,该研究揭示了Fap在心肌梗死后损伤修复中的关键作用,并阐明了其具体分子机制。由于BNP已被广泛应用于临床心力衰竭的诊断及治疗中,围绕BNP/Npr1-cGMP-PKG通路开发的多种新药已被FDA批准并应用于临床治疗,因此本研究具有巨大的转化价值,为未来心血管疾病的诊治提供了新思路和新靶点。
该研究由同济大学生命科学与技术学院岳锐教授、同济大学附属第十人民医院徐大春教授及上海交通大学附属新华医院张力教授共同指导完成。上海交通大学附属新华医院孙玉玺博士、同济大学医学院马梦秋博士为本文共同第一作者。该研究工作得到了科技部重点研发计划、国家杰出青年科学基金、国家自然科学基金等多项基金的支持。岳锐教授实验室常年招收研究生、博士后与科研助理,欢迎访问实验室网页了解详细信息:https://life.tongji.edu.cn/03/11/c12618a131857/page.htm。
参考文献:
1.Aghajanian H, Kimura T, Rurik JG, Hancock AS, Leibowitz MS, Li L, Scholler J, Monslow J, Lo A, Han W, et al. Targeting cardiac fibrosis with engineered T cells. Nature. 2019;573:430-433. doi: 10.1038/s41586-019-1546-z
2.Rurik JG, Tombácz I, Yadegari A, Méndez Fernández PO, Shewale SV, Li L, Kimura T, Soliman OY, Papp TE, Tam YK, et al. CAR T cells produced in vivo to treat cardiac injury. Science (New York, NY). 2022;375:91-96. doi: 10.1126/science.abm0594
3.Wei H, Xu Y, Wang Y, Xu L, Mo C, Li L, Shen B, Sun Y, Cheng P, Yang L, et al. Identification of Fibroblast Activation Protein as an Osteogenic Suppressor and Anti-osteoporosis Drug Target. Cell Rep. 2020;33:108252. doi: 10.1016/j.celrep.2020.108252
4.Tran E, Chinnasamy D, Yu Z, Morgan RA, Lee C-CR, Restifo NP, Rosenberg SA. Immune targeting of fibroblast activation protein triggers recognition of multipotent bone marrow stromal cells and cachexia. J Exp Med. 2013;210:1125-1135. doi: 10.1084/jem.20130110
5.Roberts EW, Deonarine A, Jones JO, Denton AE, Feig C, Lyons SK, Espeli M, Kraman M, McKenna B, Wells RJB, et al. Depletion of stromal cells expressing fibroblast activation protein-α from skeletal muscle and bone marrow results in cachexia and anemia. J Exp Med. 2013;210:1137-1151. doi: 10.1084/jem.20122344
6.Sun Y, Ma M, Cao D, Zheng A, Zhang Y, Su Y, Wang J, Xu Y, Zhou M, Tang Y, et al. Inhibition of Fap Promotes Cardiac Repair by Stabilizing BNP. Circ Res. 2023:e320781. doi: 10.1161/circresaha.122.320781
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


