Science|何川/高亚威/高绍荣教授合作阐明小鼠FTO基因通过调控LINE1 RNA的m6A修饰调控核表观与胚胎发育
N6-甲基腺嘌呤(m6A)是真核生物mRNA内部最常见和研究最为广泛的修饰,受“书写”蛋白(METTL3/METTL14复合体),“擦除”蛋白(FTO和ALKBH5)调控并经“阅读”蛋白(YTH家族蛋白等)实现功能。m6A对于mRNA的命运调控影响重大,参与剪接、转运、降解、翻译、与相分离等过程的调控;影响了个体发育和分化等生命过程,并被发现在多种疾病特别是癌症和免疫类疾病中发挥重要作用。2020年何川教授、同济大学高亚威教授和中科院基因组所韩大力教授团队合作报道了染色质相关RNAs(chromatin associate RNA,caRNAs)上m6A对转录和染色质状态的调控1,m6A在细胞核内的重要功能、特别是对于染色质和转录效率的调控也引起了其它科研团队的广泛关注2-4。但m6A擦除蛋白介导的动态去甲基化在这一调控中的作用,以及其在哺乳动物发育过程中的功能仍缺少深入研究。
FTO是首个被鉴定的RNA去甲基化酶,2011年何川教授报道FTO可以擦除mRNA内部的m6A,由此开创并引发表观转录组学/RNA表观遗传学(Epitranscriptomics/RNA epigenetics)的研究热潮。FTO与哺乳动物发育和多种人类疾病相关, Fto敲除的小鼠存在发育与代谢方面的严重缺陷。近年来,对于FTO介导的mRNA去甲基化研究主要集中在人类癌症细胞中:FTO在特定癌症细胞中可以擦除关键癌基因或抑癌基因mRNA内部的m6A并调控癌症发生发展5。与m6A碱基部分具有相同结构域的m6Am(主要位于部分mRNA 端帽邻位,含量约为mRNA内部m6A的1/10-1/30)也被报道为FTO的底物,但其生物学功能仍存在争议。与m6A甲基转移酶Mettl3敲除导致小鼠早期胚胎死亡不同, m6Am相关甲基转移酶的敲除对于小鼠的发育和生殖没有显著影响。美国芝加哥大学何川教授和同济大学高亚威/高绍荣教授团队在研究中发现Fto敲除的杂合子小鼠产生纯合敲除后代比例偏低,并且纯合敲除的雌性小鼠无法产生健康存活的后代,提示小鼠的FTO蛋白可能对于生殖发育等过程非常重要,而多个组织和细胞系的研究证据提示FTO影响生殖发育的主要生理学底物可能是核内RNA的m6A。
2022年5月5日,美国芝加哥大学何川教授和同济大学高绍荣/高亚威教授团队合作在Science在线发表题为“FTO mediates LINE1 m6A demethylation and chromatin regulation in mESCs and mouse development”的文章。该研究发现在小鼠胚胎干细胞(mice embryonic stem cell,mESCs)小鼠和人类组织以及小鼠卵母细胞及早期发育中,FTO可以调控染色质相关RNA,特别是转录自转座子元件的重复RNAs(repeats RNAs)中的Long Interspersed Nuclear Element-1 (LINE1)RNA的m6A修饰,并参与LINE1 本身以及其附近基因和反式下游的转录活性调控,影响染色质开放与组蛋白修饰,从而影响mESC的增殖分化以及早期胚胎的正常发育。该研究对于解析哺乳动物及其发育中RNA m6A修饰动态调控的生物学功能,具有重要意义。

研究团队利用Fto敲除的杂合小鼠自交产生的胚胎6,建立了Fto敲除的mESC细胞系。研究人员分析发现Fto敲除会引起mESC中caRNA 的m6A修饰水平上升,并且能够引发基因组水平的转录活性下降与染色质开放程度降低,而敲除的ES细胞在出现细胞增殖减缓的同时,其体内和体外分化能力都会出现不同程度的缺陷。测序结果表明Fto敲除后repeat RNAs,特别是LINE1 RNA上的m6A水平显著上升;同时,染色质相关LINE1 RNA ,尤其是m6A修饰高丰度的LINE1亚群 的RNA水平显著下降。通过进一步解析RNA降解与新生RNA的情况,研究人员发现mESC中Fto敲除引发LINE1 RNA的降解加速,同时引发了广泛的LINE1 RNA合成速率下降。有趣的是转录活性的降低伴随了LINE1 RNA位点附近染色质修饰H3K4Me3和H3K27Ac的下降以及H3K9Me3的上升,同时相关区域的染色质开放程度明显下降。这与已报道的染色质相关RNA上m6A能够介导RNA降解1以及招募SETDB1等表观因子建立异染色质3, 4的模型相符。
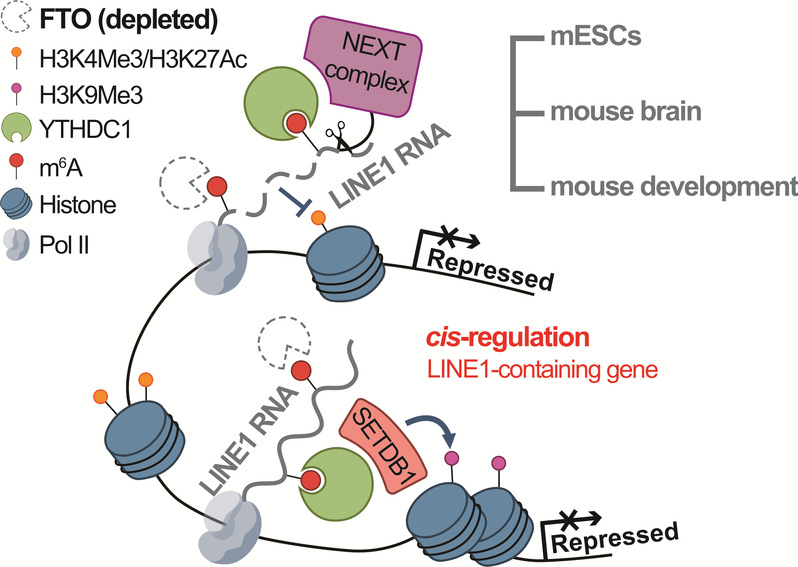
图1. FTO调控LINE1 RNA表达和附近染色质状态以及对LINE1-containing基因表达的顺式调控
之前的研究表明LINE1 RNA可以招募NCL-KAP1蛋白并反式调控(trans-regulation)类2细胞(2C-like)相关基因与逆转座子的抑制和rRNA合成的活跃7, 8。在Fto敲除的mESCs中,研究者在观测到LINE1 RNA下降的同时,也观测到了多个2C相关基因和逆转座子的上调。此外,团队在mESC中NEXT复合物的研究中发现,内含子中的LINE1 RNA丰度与宿主基因的表达存在正相关。研究团队进一步分析了LINE1附近编码基因的转录本丰度,转录活性以及表观修饰变化。结果表明在Fto敲除后,大部分包含表达降低的LINE1 RNA的编码基因(down-LINE1-containing genes)的表达也明显受到抑制,并且这些基因的转录活性以及活跃转录组蛋白修饰下降,抑制性H3K9me3水平上升,表明ES细胞内可能存在FTO-LINE1 RNA轴的顺式调控(cis-regulation)。在mESC中大约有1400个基因的表达呈现上述规律,而这些基因大多与ESC分化、转录调控和发育相关,这可能对应了FTO敲除ES细胞的分化缺陷以及纯合敲除小鼠的出生率下降。
为了验证FTO对LINE1 RNA的调控以及FTO-LINE1 RNA轴对基因表达顺式和反式调控是否依赖LINE1 RNA上m6A的擦除实现,研究者设计了dCas13b-FTO与特异性靶标的sgRNA,并将它们转入Fto敲除细胞系中,定点擦除特定LINE1族群的m6A修饰。结果发现LINE1上m6A修饰的擦除不仅能够挽救LINE1 RNA的表达、促进促进染色质的开放,也能修复2C基因的过度激活以及down-LINE1-containing基因的转录抑制。
除了mESCs,研究团队发现在小鼠和人类组织中, FTO的表达和LINE1 RNA的m6A甲基化水平负相关,并与LINE1 RNA的表达正相关。与mESCs类似,在FTO高表达的小鼠脑组织中(包括小脑、海马体以及神经干细胞),Fto的敲除导致LINE1 RNA上m6A水平上升、LINE1 RNA表达下降,同时整体上抑制了染色质的开放,表明这一调控机制可能在发育个体和正常组织细胞中广泛存在。
在小鼠的生殖发育中,包括LINE1在内的逆转座子存在阶段性的特异表达模式,并被认为深度参与了精子与卵子的分化成熟与早期胚胎的发育调控。研究团队在对于Fto敲除小鼠的表型分析中发现,Fto纯合敲除的雌鼠存在严重的生育缺陷,其与野生型交配后,产仔数显著少于野生型,并且幼崽出生一天内就发生死亡,这些结果都表明母源缺乏FTO会引发严重的发育障碍。研究人员进一步分析发现Fto敲除后四周龄小鼠的GV期(germinal vesicle)卵母细胞数目明显下降,并且NSN状态比例偏高,染色质整体开放程度下降,同时LINE1 RNA的丰度显著低于野生型。Fto敲除小鼠在超排卵处理后的排卵数目不稳定,且MII中核型不规整等纺锤体异常情况显著增高,与已报道的GV中注射L1Orf1p dsRNA诱发的卵子发育异常有一定程度的类似。
研究人员通过活精注射,获取了父母源分别(FtoP-/M+ 和FtoP+/M-)或同时(FtoP-/M-)敲除Fto的胚胎,并将其移植入假孕母鼠的子宫,分析FTO缺乏对胚胎发育的影响。结果发现母源缺乏FTO会引发胚胎着床率降低以及胚胎存活率降低,其中父母源双缺失配子产生的胚胎着床率最低,并且胎儿基本无法存活。通过相对于囊胚阶段的正常胚胎与双缺失胚胎(FtoP-/M- vs FtoP+/M+),父母源Fto双敲除的小鼠胚胎中LINE1 RNA的表达水平偏低,LINE1反式调控的2C基因与逆转座子显著上调,LINE1顺式调控的编码基因转录活性下降。与细胞中的验证实验类似,研究团队在胚胎中构建了基于CRISPR-dCas13b的LINE1 RNA位点特异性m6A擦除系统,并将该系统应用于父母源FTO双缺失的胚胎中。结果表明,通过定点清除LINE1 RNA上的m6A修饰,不仅能够显著提高LINE1 RNA的表达水平,促进囊胚中整体染色质的开放,还可以抑制2C基因与逆转座子活性,提高down-LINE1-containing基因表达。这些结果都表明FTO-LINE1 RNA轴的顺式和反式调控在早期胚胎发育中同样发挥了重要的作用。
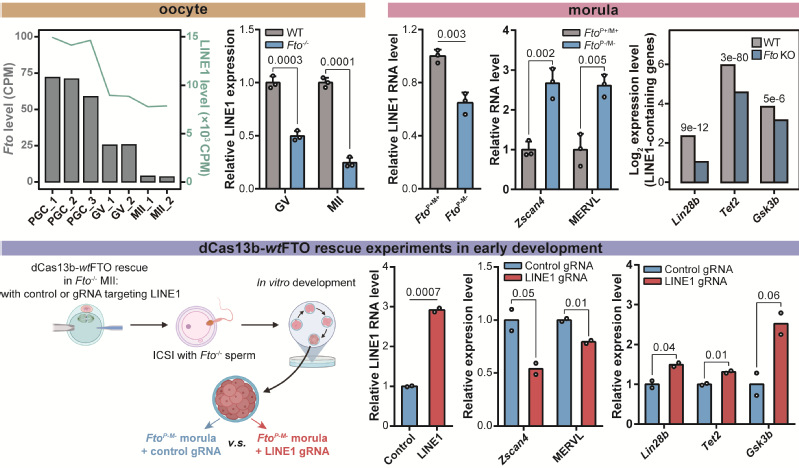
图2. FTO参与卵发育与早期胚胎中LINE1 RNA及下游基因的调控
总之,这项工作鉴定了LINE1 RNA m6A是FTO在mESCs里和小鼠发育过程中主要的功能相关底物,FTO通过m6A去甲基化调控染色质相关LINE1 RNA的表达并调节附近位点染色质修饰水平和染色质状态,并影响LINE1的顺式与反式调控下游转录本的表达。此外,贾桂芳/何川/宋宝安教授团队利用过表达FTO使水稻和马铃薯增产50%,其分子机制可能也与植物里repeat RNA的m6A去甲基化和染色质调控相关9,提示了repeat RNA的m6A去甲基化可能对不同物种体系内的表观系统都具有重要调控功能。
芝加哥大学魏江博博士、余贤斌博士,同济大学博士生杨磊、刘雪莲为本文的共同第一作者。芝加哥大学何川教授,同济大学高绍荣教授、高亚威教授为本文的共同通讯作者。浙江大学李学坤教授、南京医科大学黄伯贤副研究员和北京大学刘君研究员也参与了这一工作。该工作得到实验室其他成员和合作团队的大力支持。高绍荣、高亚威团队研究得到了科技部、国家自然科学基金委、以及上海市科委等项目的支持。
1.Liu, J. et al. N(6)-methyladenosine of chromosome-associated regulatory RNA regulates chromatin state and transcription. Science 367, 580-586 (2020).
2.Chelmicki, T. et al. m(6)A RNA methylation regulates the fate of endogenous retroviruses. Nature 591, 312-316 (2021).
3.Liu, J. et al. The RNA m(6)A reader YTHDC1 silences retrotransposons and guards ES cell identity. Nature 591, 322-326 (2021).
4.Xu, W. et al. METTL3 regulates heterochromatin in mouse embryonic stem cells. Nature 591, 317-321 (2021).
5.Li, Y., Su, R., Deng, X., Chen, Y. & Chen, J. FTO in cancer: functions, molecular mechanisms, and therapeutic implications. Trends in Cancer (2022).
6.Gao, X. et al. The fat mass and obesity associated gene FTO functions in the brain to regulate postnatal growth in mice. PLoS One 5, e14005 (2010).
7.Percharde, M. et al. A LINE1-Nucleolin partnership regulates early development and ESC identity. Cell 174, 391-405.e319 (2018).
8.Chen, C. et al. Nuclear m(6)A reader YTHDC1 regulates the scaffold function of LINE1 RNA in mouse ESCs and early embryos. Protein Cell 12, 455-474 (2021).
9.Yu, Q. et al. RNA demethylation increases the yield and biomass of rice and potato plants in field trials. Nat Biotechnol 39, 1581-1588 (2021).
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


