杜昌升教授课题组发现抑制趋化因子受体CXCR1能够减轻炎症性自身免疫疾病临床症状
2023年9月14日,Cell Death & Disease杂志在线发表了同济大学生命科学与技术学院杜昌升教授课题组完成的题为“CXCR1 drives the pathogenesis of EAE and ARDS via boosting dendritic cells-dependent inflammation”的研究论文。本文通过构建小鼠实验性自身免疫性脑脊髓炎(Experimental autoimmune encephalomyelitis,EAE)模型和急性肺损伤(Acute respiratory distress syndromes, ARDS)模型,发现趋化因子受体CXCR1调控树突状细胞炎症因子产生能力进而参与疾病进程。
多发性硬化症(Multiple sclerosis,MS)是一种慢性、炎性、中枢神经系统(Central nervous system,CNS)脱髓鞘引起的神经退行性疾病。MS发病起源于外周免疫系统,炎性Th1和Th17细胞等在外周免疫系统被抗原递呈细胞分泌的细胞因子激活,然后穿过血脑屏障,进入CNS产生炎症产物和细胞因子从而扩大相应炎性细胞环境,导致CNS局灶性淋巴细胞浸润以及神经系统综合征和身体的残疾。其发病机制仍在研究,目前尚未有药物可以逆转或完全预防MS。因此,从疾病本身出发寻找可能的作用机制,为将来的新药物开发提供更可靠的药物靶点势在必行。
本研究中,我们在MS患者中发现趋化因子受体CXCR1表达明显升高。为此,我们首先构建了CXCR1全身敲除小鼠,我们发现敲除CXCR1后CNS中炎症细胞浸润情况减轻,EAE临床症状缓解。我们进一步发现,敲除CXCR1小鼠并不直接影响体外Th1和Th17细胞的产生。基于此,我们分析发现CXCR1通过影响树突状细胞的炎症因子分泌能力,进一步影响T细胞分化。这一结论在条件敲除小鼠(树突状细胞条件敲除CXCR1)和CXCR1配体CXCL5中和抗体动物模型中均得到了证实。机制研究中,我们发现树突状细胞体内存在CXCL5/CXCR1/HIF-1α正反馈调节环调控炎症因子(IL-6和IL-12)生成。在急性肺损伤模型中我们印证了这一机制。总之,我们的工作表明抑制趋化因子受体CXCR1可减少树突状细胞的炎症反应,减轻炎症性自身免疫疾病的临床症状,这表明CXCR1可能是治疗炎症性自身免疫疾病的一种有希望的潜在药物靶点。
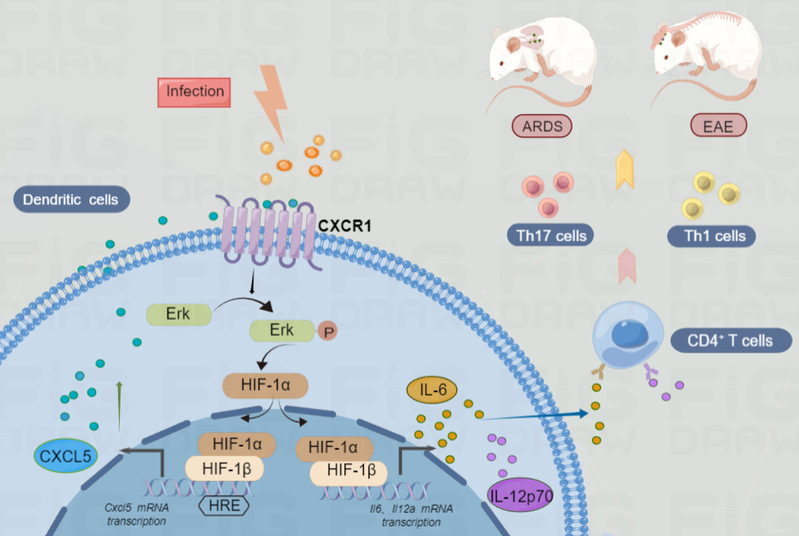
图1:CXCR1通过CXCL5/CXCR1/HIF-1α正反馈环调控树突状细胞的炎症反应,促进T细胞分化,加重EAE和ARDS疾病进程,这些发现提示CXCR1将成为炎症性自身免疫疾病治疗的新突破口。
本研究在杜昌升教授指导下完成。论文的第一作者为来自同济大学生命科学与技术学院博士研究生庄伟,周金凤和上海市东方医院南院消化内科的钟岚教授。参与此项研究工作的还有同济大学生命科学与技术学院的吕婕老师,上海东方医院研究生钟旋,研究生谢玲、王纯、韩三省、凯迪热亚·赛买尔以及同济大学上海信号转导与疾病研究重点实验室的谢欣老师、张儒老师、石昌杰老师和花秋红老师。杜昌升教授为本论文的独立通讯作者。以上研究得到国家自然科学基金的资助。
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


