Science Bulletin|高绍荣/毛志勇/高帅合作发现Xrcc1基因介导的高效碱基切除修复(BER)可改善iPSCs基因组稳定性和多能性
通过特定的转录因子将终末分化的体细胞重编程为多能干细胞,即iPS细胞,是近年来生命科学领域的一大里程碑事件。因其具有类似胚胎干细胞的多能性,拥有发育成各种成体细胞的能力,且彻底解决了胚胎干细胞临床应用中的细胞来源和伦理问题,对再生医学的发展提供了有力的支持,也开辟了个体化治疗的全新领域。正因如此,iPS细胞的临床应用安全越来越被高度重视,其中如何维持重编程获得的终态iPS细胞的基因组稳定性被认为是亟待解决的核心问题之一。迄今,多个研究表明体细胞诱导重编程过程会引入数以千计的遗传畸变,进而损害iPS细胞的基因组完整性,如何高效可靠地消除重编程引入的突变值得科学家们探寻。
同济大学生命科学与技术学院高绍荣团队和毛志勇团队,以及中国农业大学的高帅课题组,4月3日在Science Bulletin在线发表题为“Enhancement of Xrcc1-mediated base excision repair (BER) improves the genetic stability and pluripotency of iPSCs”的研究论文,报道了XRCC1介导的碱基切除修复(BER)的增强可以降低体细胞诱导重编程过程中引入的单核苷酸变异(SNVs),进而提高iPS细胞基因组的稳定性和多能性。
2015年,高绍荣团队就在Nature Communications发表论文,利用课题组首次建立的连续六次诱导重编程体系证实SNVs在体细胞诱导重编程过程中的产生并逐渐积累,最终会致使iPS细胞的多能性降低,丧失发育成完整健康个体的潜能。研究人员以此为基础推测:重编程的过程中某些DNA修复通路的不足,会导致DNA损伤无法被及时地修复,进而造成了SNVs在终态iPS细胞中积累。利用已成熟建立的报告系统,研究人员对包括BER、核苷酸切除修复(NER)、非同源末端连接(NHEJ)和同源重组(HR)在内的四种DNA修复通路在重编程过程中的效率变化做了检测,发现BER通路在重编程的早中期严重不足,无法应对在重编程早期就快速升高的活性氧(ROS)及其造成的氧化性碱基损伤。通过对BER通路因子进行筛选,研究人员成功得到可以增强BER的成员XRCC1。在重编程过程中与OSKM四因子同时过表达XRCC1可以显著提高重编程早中期的BER水平,并最终显著减少终态iPS细胞的SNVs数量,同时修复了近期有研究人员报道重编程过程中会引入的主要来源于氧化类的损伤SBS17b(Signature 17)。研究者们还发现XRCC1可以提高重编程的效率,显著改善获得iPS细胞的多能性。综上,该研究提供了一种可以有效减少重编程过程引入基因突变的方法(图1),为iPS细胞未来的临床应用安全提供了新的解决思路。
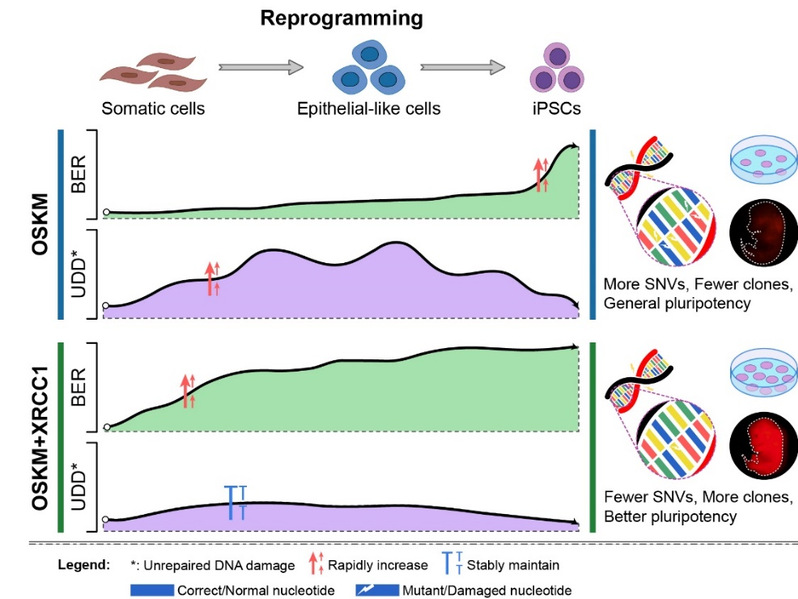
图1 XRCC1提高BER,减少SNVs并改善iPS细胞质量
同济大学生命科学与技术学院的博士研究生赵堃、孙小翔,以及中国科学院基因组所郑彩宏博士为该论文的共同第一作者。研究得到科技部、国家自然科学基金委、以及上海市科委等支持。
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


