Stem Cell Reports | 康九红课题组揭示lncRNA Cpmer靶向调控Eomes mRNA翻译和心肌命运决定的表观遗传新机制
2022年4月7日,同济大学生命科学与技术学院康九红教授课题组在《Stem Cell Reports》杂志在线发表题为“Cpmer: a new conserved eEF1A2-binding partner that regulates Eomes translation and cardiomyocyte differentiation”的研究论文,该研究揭示了一个在人和小鼠中功能保守的新型lncRNA Cpmer(Cytoplasmic mesoderm regulator),通过结合翻译延伸因子eEF1A2,并识别心肌中胚层关键转录因子Eomes的mRNA序列,从而靶向调控Eomes mRNA翻译和心肌分化进程。
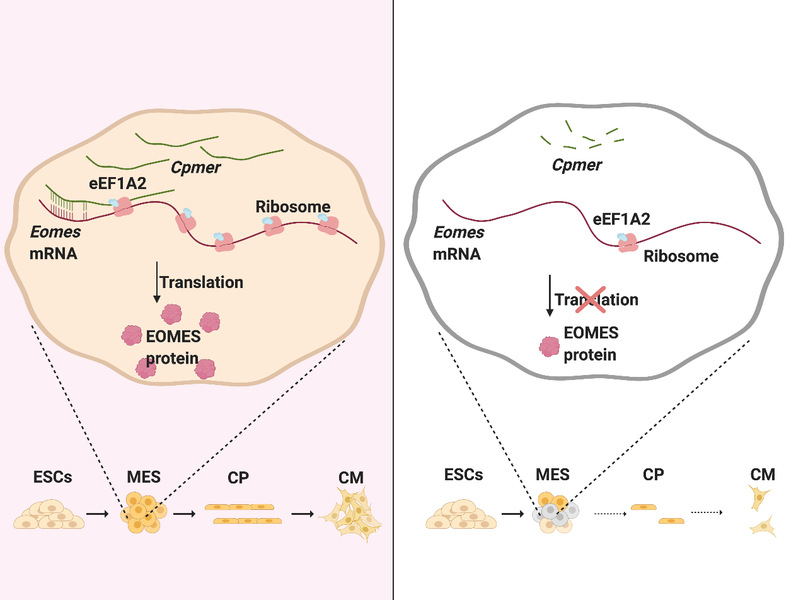
哺乳动物的心脏发育是多因子、多通路协同作用的多步骤复杂过程,而在心脏发育的各个阶段,关键编码基因的正常表达是保证心脏顺利形成的前提条件。以往研究显示心脏发育中关键基因的转录过程可以受到多个层面的严格调控,但关键基因在转录后调控方面的研究较为缺乏。LncRNA作为一类重要的表观遗传调节分子,得益于其较强的组织和阶段表达特异性,可介导重要且精准的表观调控作用而受到广泛关注。然而,lncRNA在心肌谱系分化过程中对于特定基因的转录后调控研究仍存在着很大的空白。
在本研究中,我们发现lncRNA Cpmer在心肌分化过程中从中胚层阶段起显著表达上调,其缺失会显著抑制ESC分化形成心肌细胞。机制研究发现主要分布在细胞质的Cpmer能够通过RNA序列匹配方式,识别并结合重要的中胚层转录因子Eomes的mRNA序列。进一步研究还发现Cpmer是依赖于其与翻译延伸因子eEF1A2的结合和对多聚核糖体的招募,进而调控Eomes mRNA的顺利翻译和心肌细胞的正常分化。更重要的是,人源转录本CPMER同样具有结合eEF1A2蛋白,识别EOMES mRNA序列,进而调控EOMES mRNA翻译和人源心肌细胞分化的保守机制和功能。总之,本研究不仅揭示了eEF1A2这一早期心脏发育中保守的翻译调节因子与Cpmer互作调控Eomes mRNA翻译的重要机制,完善了对Eomes上游翻译调控机制的认识,而且揭示了Cpmer依靠其序列识别和蛋白招募的双重作用,介导eEF1A2特异性调控Eomes mRNA翻译的表观调控新机制,为研究转录后调控的表观遗传特异性提供了新的维度。
同济大学康九红教授、郭旭东研究员为本文的通讯作者,博士研究生吕瑶为该文第一作者。该工作得到了科技部重点研发计划、国家自然科学基金委、上海市科委、中央高校基金等项目的支持。
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


