Cell Research |岳锐/刘兵/朱恒合作揭示早期人类胚胎骨骼干细胞起源
骨骼干细胞(Skeletal stem cell, SSC)是一群能够自我更新并分化产生软骨细胞、成骨细胞和基质细胞的组织特异性干细胞,在骨骼发育和损伤修复过程中发挥关键作用【1】。与静脉窦周的骨髓间充质干细胞不同,SSC主要位于小鼠长骨生长板和骨外膜,且不具有在体分化为脂肪细胞的能力【1-4】。最近的研究发现,SSC也存在于孕17周人类胎儿长骨生长板中【5】,然而SSC在早期人类胚胎中的起源、分子特征及其调控机制仍不清楚。
2021年1月20日,同济大学生命科学与技术学院、同济大学附属东方医院再生医学研究所岳锐课题组联合解放军总医院第五医学中心刘兵课题组和北京放射医学研究所朱恒课题组在Cell Research(IF=20.51)杂志在线发表了题为”Dissecting human embryonic skeletal stem cell ontogeny by single-cell transcriptomic and functional analyses”的研究论文(Article)。该研究利用单细胞转录组测序绘制了早期人类胚胎肢芽、长骨和颅骨的发育图谱,并结合体内外功能验证发现了一群定位于软骨外膜,具有自我更新和分化为软骨与成骨细胞潜能的胚胎骨骼干祖细胞(Embryonic skeletal stem and progenitor cell, eSSPC)。该工作系国际上首次针对早期人类胚胎骨骼干细胞起源和异质性的研究,对于深入理解人类骨骼发育及损伤修复机制具有重要意义。

研究人员首先选取孕5周人类胚胎肢芽,以及孕8周人类胚胎长骨进行高通量单细胞转录组测序,通过整合分析鉴定得到16个主要细胞类群。其中肢芽样本富集了间质细胞和上皮细胞类群,而长骨样本则富集了成骨前体细胞和软骨细胞类群。根据转录组特征和假时序分析,研究人员发现高表达TWIST2和PDGFRA的成骨软骨前体细胞(Osteo-chondrogenic progenitor,OCP)在肢芽和长骨样本中均存在,提示最早的骨骼干祖细胞可能包含于其中(图1)。
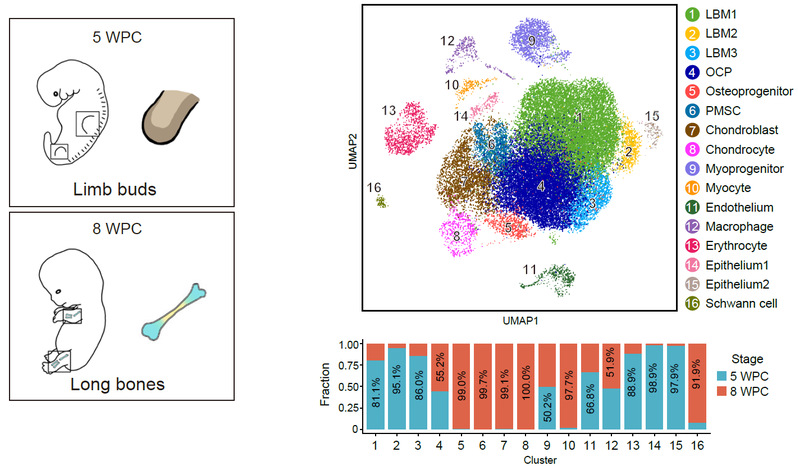
图1. 人胚肢芽和长骨的单细胞转录组全景图
研究人员通过对肢芽样本的深入分析发现了4群间质细胞和2群上皮细胞,并利用已知基因标志物解析了其在肢芽中的空间分布情况以及转录调控特征。接下来,研究人员通过对胚胎长骨OCP细胞进一步分群鉴定得到3群干祖细胞,其中包括肢芽来源间质细胞(LBDMC)、骨髓基质细胞(BMSC)、以及一群具有分化为成骨前体细胞和软骨细胞潜能的骨骼干祖细胞(eSSPC)。转录调控网络分析发现eSSPC富集了转录因子FOXP1/2。免疫荧光染色显示FOXP1/2+细胞主要定位于软骨外膜和新生的初级骨化中心内部(图2),这与此前在小鼠中发现的软骨外膜前体细胞非常相似【6】。随后,研究人员在差异基因中筛选得到一组细胞表面标志物(PDGFRAlow/-PDPN+CADM1+)用于分选富集eSSPC群体,发现其具有较强的体外克隆形成能力。连续性克隆传代以及体内外分化实验证明eSSPC具有自我更新和成骨、成软骨分化潜能,但无法维持造血微环境(图2)。此外,研究人员还对孕8周人类胚胎颅顶骨进行了单细胞转录组测序,发现了一群同样具有PDGFRAlow/-PDPN+CADM1+表型的神经脊来源细胞(Neural crest derived cells, NCDCs)在颅缝和软骨膜内富集,暗示其可能在膜内成骨和颅骨发育过程中发挥关键作用。
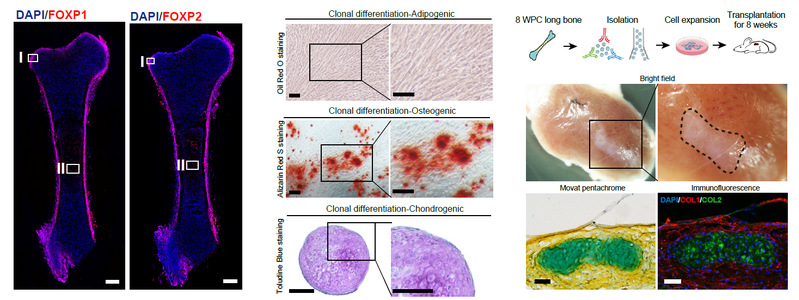
图2. 胚胎骨骼干祖细胞(eSSPC)的特征和功能鉴定
总而言之,该研究首次绘制了早期人类胚胎骨骼发育的单细胞图谱,从转录组和功能学层面鉴定得到一群胚胎骨骼干祖细胞(eSSPC),提示人类骨骼干细胞有可能起源于胚胎软骨膜内(图3)。鉴于成体骨骼损伤修复极大程度上模拟了胚胎发育过程,这一发现也为骨骼再生障碍性疾病的治疗提供了新思路。
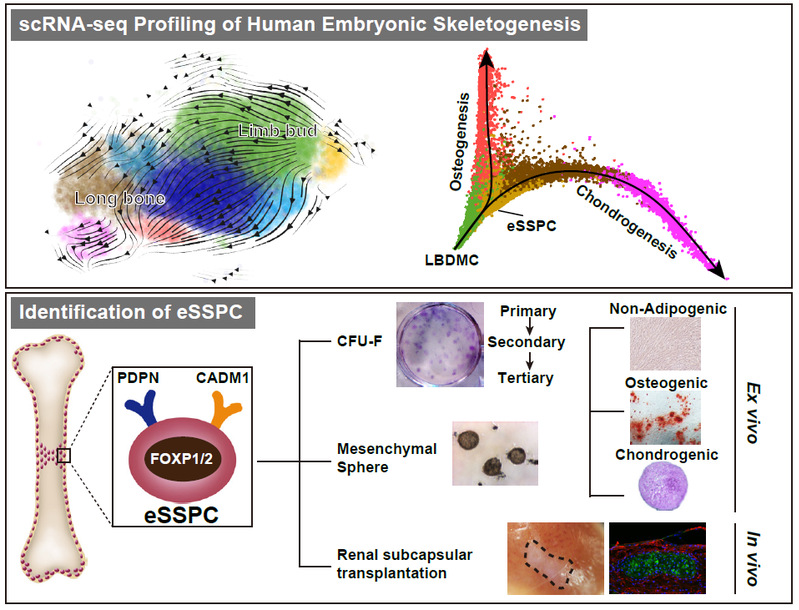
图3. 胚胎骨骼发育和eSSPC的研究模型
同济大学生命科学与技术学院岳锐教授,解放军总医院第五医学中心刘兵研究员及北京放射医学研究所朱恒副研究员为该论文的共同通讯作者,博士研究生贺健,晏婧,汪健芳,辛倩和海军军医大学长征医院赵良瑜副教授为论文的共同第一作者。
参考文献
1. Chan, Charles KF, et al. Identification and specification of the mouse skeletal stem cell. Cell 160.1-2 (2015): 285-298.
2. Worthley, Daniel L., et al. Gremlin 1 identifies a skeletal stem cell with bone, cartilage, and reticular stromal potential. Cell 160.1-2 (2015): 269-284.
3. Mizuhashi, Koji, et al. Resting zone of the growth plate houses a unique class of skeletal stem cells. Nature 563.7730 (2018): 254-258.
4.Debnath, Shawon, et al. Discovery of a periosteal stem cell mediating intramembranous bone formation. Nature 562.7725 (2018): 133-139.
5.Chan, Charles KF, et al. Identification of the human skeletal stem cell. Cell 175.1 (2018): 43-56.
6. Zhao, Haixia, et al. Foxp1/2/4 regulate endochondral ossification as a suppresser complex. Developmental biology 398.2 (2015): 242-254.
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


