高绍荣/鞠振宇/乐融融在《Cell Stem Cell》发表论文,揭示Dcaf11调控小鼠胚胎发育端粒延伸的作用机制
2020年12月24日,来自同济大学生命科学与技术学院高绍荣教授领导的团队与暨南大学鞠振宇教授领导的团队在Cell Stem Cell杂志上发表了题为“Dcaf11 activates Zscan4-mediated alternative telomere lengthening in early embryos and embryonic stem cells”的研究成果。该研究在小鼠胚胎干细胞中进行了ALT相关因子的筛选,发现了Dcaf11在小鼠早期胚胎和胚胎干细胞ALT介导的端粒延伸和维持中发挥重要作用。Dcaf11缺失会导致小鼠端粒缩短,进而引发Dcaf11敲除小鼠骨髓造血干细胞造血重建能力及应激状态下的损伤修复能力显著下降。随后,研究人员研究了Dcaf11的互作蛋白,发现Dcaf11可促进Kap1泛素化降解,进而激活ALT相关基因Zscan4的表达。该工作揭示了早期胚胎ALT过程中的关键因子及作用机制,为进一步理解早期胚胎ALT机制提供了重要的线索。

端粒能防止染色体末端的重组和降解,对细胞维持染色体的稳定性有重要的作用(Blasco, 2005)。成体细胞由于缺乏有效的端粒维持机制,端粒在胞分裂中逐渐缩短,最终引发细胞分裂的停滞和衰老(Blasco, 2005; Harley et al., 1990)。端粒缩短是引发个体衰老的重要原因,是许多人类衰老相关疾病的典型病症(Cawthon et al., 2003; Lopez-Otin et al., 2013; Oh et al., 2003; Samani et al., 2001)。端粒的延伸可以通过两种机制来实现:端粒酶依赖机制和不依赖端粒酶的端粒延长机制(Alternative lengthening of telomeres,ALT)(Greider and Blackburn, 1985; Henson et al., 2002; Liu et al., 2007)。ALT是小鼠早期胚胎和胚胎干细胞端粒延长的重要机制(Liu et al., 2007; Tardat and Dejardin, 2018; Zalzman et al., 2010)。此外,约有10-15%肿瘤细胞依赖于ALT 机制来进行端粒延长(Dunham et al., 2000; Shay and Bacchetti, 1997)。然而,目前人们对于ALT发生过程的具体分子机制知之甚少。
2014年,高绍荣教授课题组利用端粒酶敲除小鼠模型研究了核移植技术、iPS技术重编程端粒缺陷的能力,研究表明卵母细胞中存在着能高效修复供体细胞端粒缺陷的ALT因子(Le et al., 2014)(第一作者为乐融融博士)。然而参与胚胎ALT机制的关键因子及分子机制还尚不明晰。早期胚胎的匮乏极大地限制了相关研究工作的开展。为了解答这个问题,高绍荣课题组利用高灵敏的蛋白定量质谱技术,检测了小鼠植入前胚胎受精卵,2-细胞,4-细胞,8-细胞,桑葚胚和囊胚等六个时期的蛋白质组信息,成功确认了植入前胚胎中四千多个蛋白的含量变化信息,并首次绘制了小鼠植入前胚胎蛋白质组动态图谱(Gao et al., 2017)。基于这一信息,团队研究成员进一步在胚胎干细胞中对早期胚胎中潜在的ALT相关因子进行了筛选,并发现了一系列影响早期胚胎ALT过程的基因,其中Dcaf11对于促进胚胎干细胞ALT的激活最为明显。随后研究人员构建了Dcaf11敲除小鼠,分析了Dcaf11在小鼠胚胎发育中的作用。结果显示Dcaf11的缺失会引起小鼠植入前胚胎发育率下降、基因表达异常和卵裂期胚胎端粒延伸速率下降。
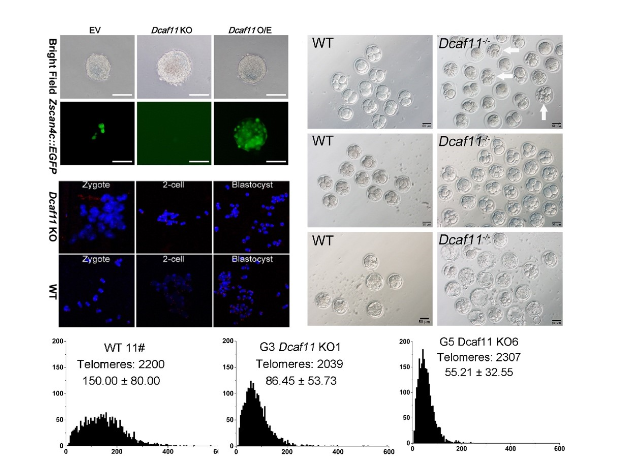
图1. Dcaf11对Zscan4激活、胚胎发育以及端粒延长和维持的影响
随Dcaf11敲除小鼠代数的增加,Dcaf11敲除小鼠端粒逐渐缩短。晚代数Dcaf11敲除小鼠骨髓造血干细胞造血重建能力及在应激状态下的损伤修复能力显著下降。
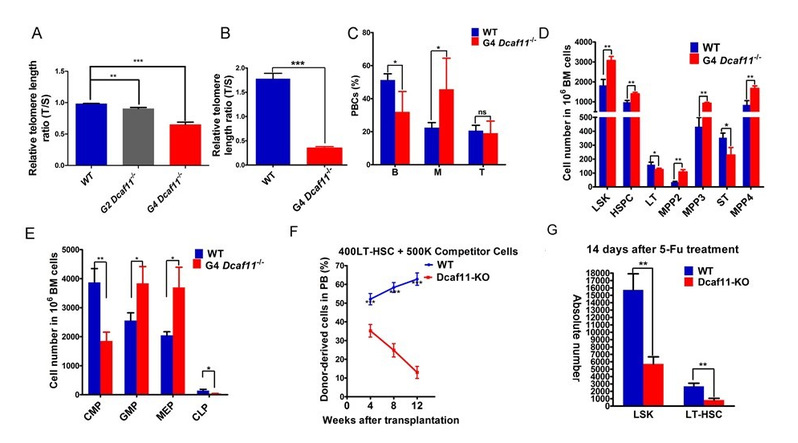
图2. Dcaf11敲除小鼠骨髓造血干细胞造血重建能力和损伤修复能力显著下降
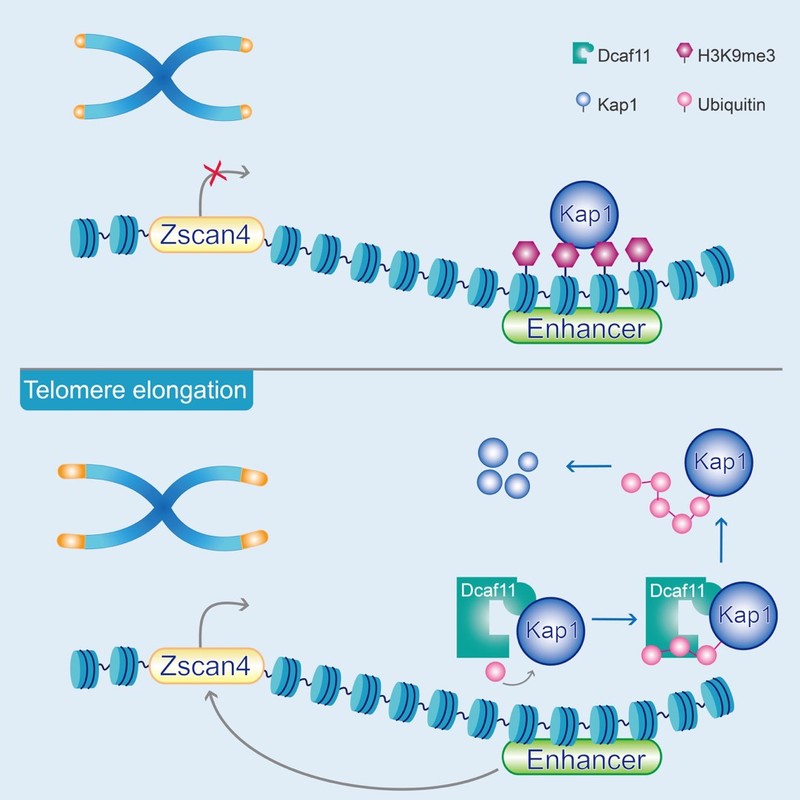
接下来研究人员对Dcaf11促进端粒延长的机制进行了探究。研究人员发现,Dcaf11作为E3泛素连接酶识别蛋白,靶向底物Kap1并促进其降解。在Dcaf11敲除的ESC中敲降Kap1可重新激活Zscan4,进而修复Dcaf11缺失引发的端粒缺陷,表明Dcaf11通过降解Kap1来激活Zscan4介导的端粒延伸。研究者们进一步发现Kap1可结合在Zscan4的下游增强子上,通过维持该处的H3K9me3修饰来抑制Zscan4的激活。当细胞中过表达Dcaf11时,结合在Zscan4增强子处的Kap1被降解,Zscan4得以激活,进而促进端粒延长。
综上所述,这项研究揭示了Dcaf11在早期胚胎ALT介导的端粒延伸中的作用机制,为进一步理解早期胚胎端粒延伸和调控机制提供重要线索。
同济大学高绍荣课题组助理教授乐融融、直博生黄忆鑫、助理研究员张艳平、暨南大学鞠振宇课题组汪虎教授、同济大学高绍荣课题组硕士生林嘉明为该论文的共同第一作者,高绍荣教授、鞠振宇教授、乐融融助理教授为共同通讯作者。该研究得到了科技部重点研发计划、国家自然科学基金委、上海市科委等项目的支持。
文献引用
Blasco, M.A. (2005). Telomeres and human disease: ageing, cancer and beyond. Nat Rev Genet 6, 611-622.
Cawthon, R.M., Smith, K.R., O'Brien, E., Sivatchenko, A., and Kerber, R.A. (2003). Association between telomere length in blood and mortality in people aged 60 years or older. Lancet 361, 393-395.
Dunham, M.A., Neumann, A.A., Fasching, C.L., and Reddel, R.R. (2000). Telomere maintenance by recombination in human cells. Nat Genet 26, 447-450.
Gao, Y., Liu, X., Tang, B., Li, C., Kou, Z., Li, L., Liu, W., Wu, Y., Kou, X., Li, J., et al. (2017). Protein Expression Landscape of Mouse Embryos during Pre-implantation Development. Cell Rep 21, 3957-3969.
Greider, C.W., and Blackburn, E.H. (1985). Identification of a specific telomere terminal transferase activity in Tetrahymena extracts. Cell 43, 405-413.
Harley, C.B., Futcher, A.B., and Greider, C.W. (1990). Telomeres Shorten during Aging of Human Fibroblasts. Nature 345, 458-460.
Henson, J.D., Neumann, A.A., Yeager, T.R., and Reddel, R.R. (2002). Alternative lengthening of telomeres in mammalian cells. Oncogene 21, 598-610.
Le, R., Kou, Z., Jiang, Y., Li, M., Huang, B., Liu, W., Li, H., Kou, X., He, W., Rudolph, K.L., et al. (2014). Enhanced telomere rejuvenation in pluripotent cells reprogrammed via nuclear transfer relative to induced pluripotent stem cells. Cell Stem Cell 14, 27-39.
Liu, L., Bailey, S.M., Okuka, M., Munoz, P., Li, C., Zhou, L., Wu, C., Czerwiec, E., Sandler, L., Seyfang, A., et al. (2007). Telomere lengthening early in development. Nat Cell Biol 9, 1436-1441.
Lopez-Otin, C., Blasco, M.A., Partridge, L., Serrano, M., and Kroemer, G. (2013). The hallmarks of aging. Cell 153, 1194-1217.
Oh, H., Wang, S.C., Prahash, A., Sano, M., Moravec, C.S., Taffet, G.E., Michael, L.H., Youker, K.A., Entman, M.L., and Schneider, M.D. (2003). Telomere attrition and Chk2 activation in human heart failure. Proc Natl Acad Sci U S A 100, 5378-5383.
Samani, N.J., Boultby, R., Butler, R., Thompson, J.R., and Goodall, A.H. (2001). Telomere shortening in atherosclerosis. Lancet 358, 472-473.
Shay, J.W., and Bacchetti, S. (1997). A survey of telomerase activity in human cancer. Eur J Cancer 33, 787-791.
Tardat, M., and Dejardin, J. (2018). Telomere chromatin establishment and its maintenance during mammalian development. Chromosoma 127, 3-18.
Zalzman, M., Falco, G., Sharova, L.V., Nishiyama, A., Thomas, M., Lee, S.L., Stagg, C.A., Hoang, H.G., Yang, H.T., Indig, F.E., et al. (2010). Zscan4 regulates telomere elongation and genomic stability in ES cells. Nature 464, 858-863.
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


