高绍荣/江赐忠/陈嘉瑜在《Cell Stem Cell》发表论文,揭示H3K9ac修饰异常是体细胞核移植胚胎重编程的重要表观遗传障碍,并开发出提高克隆胚胎发育的新方法
2020年10月12日,同济大学生命科学与技术学院高绍荣、江赐忠及陈嘉瑜等合作在《Cell Stem Cell》 杂志在线发表了题为“Dux-Mediated Corrections of Aberrant H3K9ac during 2-Cell Genome Activation Optimize Efficiency of Somatic Cell Nuclear Transfer”的研究成果。该研究基于对正常受精胚胎,体细胞核移植胚胎,以及组蛋白去乙酰化酶抑制剂TSA处理后的核移植胚胎的H3K9ac组蛋白修饰的平行分析,发现H3K9ac修饰异常是核移植胚胎重编程的重要表观遗传障碍,鉴定出一系列以H3K9ac标记的重编程异常区域(aberrantly acetylated region, AAR),并首次揭示了TSA挽救核移植胚胎发育受限于体细胞原有表观遗传特性。随后,研究人员通过转录因子motif分析,利用已建立的H3K9ac图谱鉴定出潜在的挽救靶点—Dux,并通过人为干预Dux水平,成功实现核移植胚胎发育的精确挽救并进行了后续深入的机制论证。

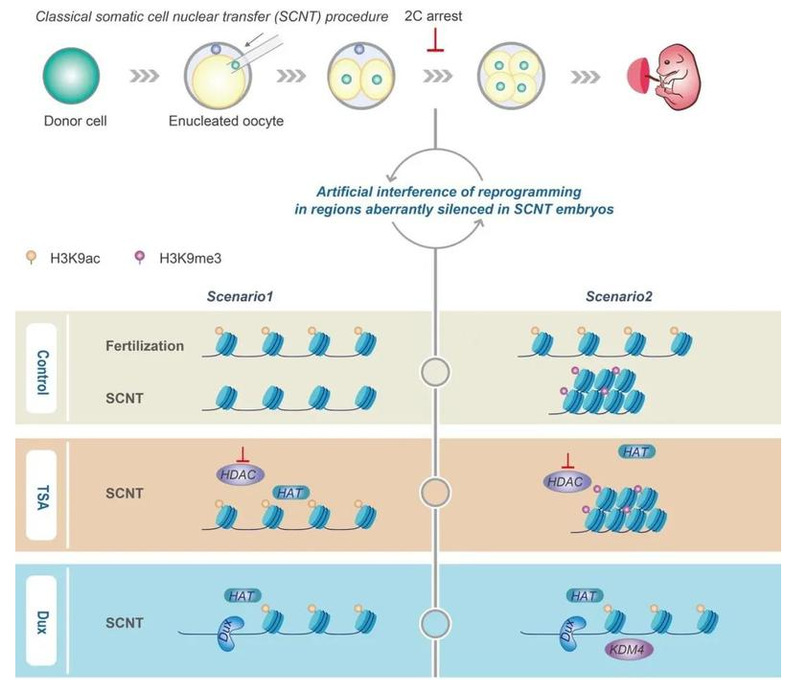
体细胞核移植(SCNT)技术(又称为克隆)是将分化的体细胞核移入去核卵母细胞内,使体细胞的染色质发生重编程,继而启动胚胎发育到完整个体的技术。虽然SCNT是目前为止唯一一种可以使体细胞获得全能性的方式,但由于重编程中存在多种表观遗传障碍,使得体细胞重编程不完全,造成核移植胚胎发育潜能极低,这也极大程度地限制了该项技术的应用前景。高绍荣课题组长期聚焦于体细胞重编程的表观遗传重塑机制研究,近几年先后发现组蛋白H3K9me3和H3K4me3修饰异常(Liu et al., 2016a),遗传自供核细胞的DNA再甲基化记忆(Gao et al., 2018)等是体细胞核移植的表观遗传障碍,而打破克隆胚胎中的多种表观重编程壁垒能显著提高克隆效率。此外,组蛋白去乙酰化酶抑制剂TSA是一个经典的可提升核移植胚胎发育率的处理方式,克隆胚胎经过TSA处理后,其产生克隆动物的效率可从1%提升至6%。
早在2007年,高绍荣课题组发现SCNT胚胎与受精胚胎相比存在H3K9ac修饰缺陷,而TSA处理可以较好修复该缺陷(Wang et al., 2007)(第一作者为北京生命科学研究所王凤超博士),但是H3K9ac的缺陷及修复如何影响重新编程的机制仍然不清楚,这个问题困扰了课题组长达十年之久。直至高绍荣课题组成功利用微量组学技术对小鼠早期胚胎发育中的组蛋白修饰变化进行探究后(Liu et al., 2016b),课题组终于有机会和能力对这一问题进行深入探究。2017年底开始,团队研究人员开始利用微量组学技术对正常胚胎及SCNT胚胎发育中的组蛋白H3K9ac修饰图谱进行了绘制,发现了一系列SCNT胚胎中的异常乙酰化区(AAR)是重编程的表观遗传障碍,这些区域包含许多对胚胎发育至关重要的基因,而这些基因在SCNT胚胎中显著失调,例如2C基因表达受到普遍抑制。进一步研究发现,虽然TSA处理可以在很大程度上修复大多数AAR并提高SCNT效率,但其作用受到供体细胞中固有的表观遗传环境的限制(例如,不能修复H3K9me3标记的重编程抑制区域(RRR)),表明其拯救作用存在选择性,是不充分的。这也提示,传统以酶作为靶点进行的表观干预手段,可能都会存在类似特性(图1)。
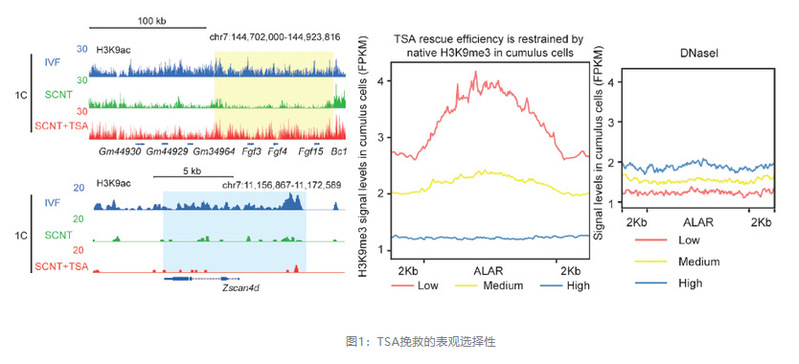
在2018年底,文章共同第一作者杨光通过对比正常胚胎及SCNT胚胎的H3K9ac动态变化区域,发现仅在早期2细胞(e2C)阶段的正常受精胚胎中,存在明显的Dux motif富集,而Dux在SCNT胚胎中沉默,其基因座区域富集了抑制性H3K9me3修饰(图2)。

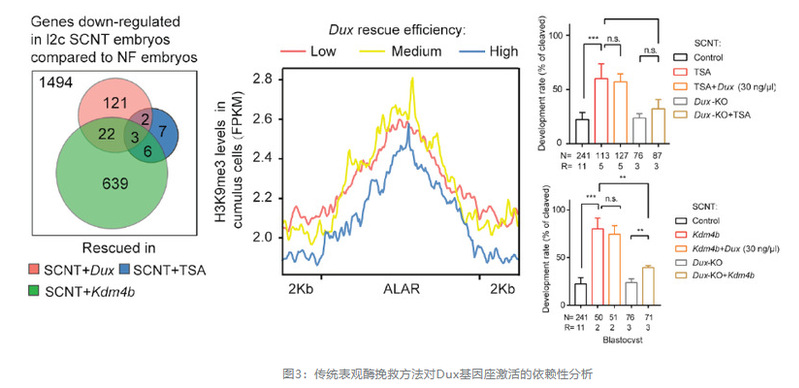
2019年开始,研究人员对Dux在SCNT胚胎中的作用进行了细致探究,发现全长Dux的表达可挽救AAR中H3K9ac水平,针对性地驱动2C基因和重复序列活化,并显著提高SCNT胚胎体内、外的发育效率。此外,通过构建不同C端敲除的缺陷型Dux,研究人员发现Dux C末端域对于修复异常的乙酰化和促进重编程至关重要。最后,研究人员进一步梳理了Dux,Kdm4,TSA三种挽救方法的关联性,证明Dux和后两者挽救的基因表达具有一定程度的重叠,但相对TSA而言不受限于体细胞原来的表观遗传特性。2020年,研究人员利用实验室前期建立的Dux-KO母鼠(Guo et al., 2019)的颗粒细胞为供体,进一步发现Dux基因座的敲除极大程度削弱了Kdm4和TSA对SCNT胚胎发育的促进作用。值得注意的是,内蒙古大学李光鹏教授课题组近期的研究,通过筛选也证实激活Dux可以提高核移植胚胎发育率,并促进细胞诱导重编程的建立(Yang et al., 2020b)。
此外,2020年王建龙课题组与高绍荣课题组合作揭示了Dux-miR-344-Zmym2介导的MERVL激活在全能性样细胞产生过程中的作用(Yang et al., 2020a)(图3)。
综上所述,这项研究发现H3K9ac异常是体细胞核移植胚胎重编程的重要表观遗传障碍,进一步发现转录因子Dux可精确进行表观遗传调控从而提高SCNT胚胎发育率,该研究为提高哺乳动物克隆效率提供了新方法。
同济大学直博生杨光、张林凤博士和刘文强研究员为本文的共同第一作者。江赐忠教授、陈嘉瑜副教授及高绍荣教授为本文的共同通讯作者。该研究得到了科技部重点研发计划、国家自然科学基金委、上海市科委等项目的支持。
文献引用:
Gao, R., Wang, C., Gao, Y., Xiu, W., Chen, J., Kou, X., Zhao, Y., Liao, Y., Bai, D., Qiao, Z., et al. (2018). Inhibition of Aberrant DNA Re-methylation Improves Post-implantation Development of Somatic Cell Nuclear Transfer Embryos. Cell Stem Cell 23, 426-435 e425.
Guo, M., Zhang, Y., Zhou, J., Bi, Y., Xu, J., Xu, C., Kou, X., Zhao, Y., Li, Y., Tu, Z., et al. (2019). Precise temporal regulation of Dux is important for embryo development. Cell Res 29, 956-959.
Liu, W., Liu, X., Wang, C., Gao, Y., Gao, R., Kou, X., Zhao, Y., Li, J., Wu, Y., Xiu, W., et al. (2016a). Identification of key factors conquering developmental arrest of somatic cell cloned embryos by combining embryo biopsy and single-cell sequencing. Cell Discov 2, 16010.
Liu, X., Wang, C., Liu, W., Li, J., Li, C., Kou, X., Chen, J., Zhao, Y., Gao, H., Wang, H., et al. (2016b). Distinct features of H3K4me3 and H3K27me3 chromatin domains in pre-implantation embryos. Nature 537, 558-562.
Wang, F., Kou, Z., Zhang, Y., and Gao, S. (2007). Dynamic reprogramming of histone acetylation and methylation in the first cell cycle of cloned mouse embryos. Biol Reprod 77, 1007-1016.
Yang, F., Huang, X., Zang, R., Chen, J., Fidalgo, M., Sanchez-Priego, C., Yang, J., Caichen, A., Ma, F., Macfarlan, T., et al. (2020a). DUX-miR-344-ZMYM2-Mediated Activation of MERVL LTRs Induces a Totipotent 2C-like State. Cell Stem Cell 26, 234-250 e237.
Yang, L., Liu, X., Song, L., Di, A., Su, G., Bai, C., Wei, Z., and Li, G. (2020b). Transient Dux expression facilitates nuclear transfer and induced pluripotent stem cell reprogramming. EMBO Rep 21, e50054.
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


