毛志勇/孙方霖团队合作开发治疗肝细胞癌(hepatocellular carcinoma, HCC)的新型联合疗法
全球每年有近60万人因肝癌死亡,在所有癌症的死亡人数中排名第二(1);而由于乙肝流行等因素,中国成为世界范围内的肝癌高发地区,肝癌发病率约为欧美国家的4倍。在所有不同类型肝癌中,肝细胞癌(hepatocellular carcinoma, HCC)最为常见。由于缺少有效的分子靶向治疗手段,HCC的致死率依然居高不下,5年生存率仅为10%
DNA双链断裂(DNA double strand breaks, DSBs)是对机体危害最大的DNA损伤类型,这种损伤由独立且互相竞争的同源重组 (Homologous recombination, HR)和非同源末端连接(Nonhomologous end joining, NHEJ)来修复,以维持基因组的稳定性。DNA修复能力下降引发的基因组不稳定现象是包括肝癌在内的多种肿瘤发生的重要诱因
2020年 10月5日,同济大学生命科学与技术学院毛志勇团队和孙方霖团队联合在Proceedings of the National Academy of Sciences上在线发表了题为 Rational combination therapy for hepatocellular carcinoma with PARP1 and DNA-PK inhibitors 的工作,该研究工作首次利用小鼠报告模型在体内比较了HCC和癌旁组织的DSB修复能力,发现:HCC中 HR 和 NHEJ 修复效率均显著上调,而PARP1 和 DNA-PKcs是介导该变化的关键基因。进一步的研究提示:同时靶向抑制 PARP1 和 DNA-PKcs 酶活显著抑制了小鼠原位HCC和人HCC的PDX模型的增殖,提示其具有重要的潜在临床应用价值。

研究团队将基于绿色荧光蛋白 GFP 建立的检测HR的报告载体整合到小鼠基因组Rosa26位点(图1),建立了体内检测HR效率的报告小鼠模型,同时结合Gorbunova教授课题组赠予的NHEJ报告小鼠模型
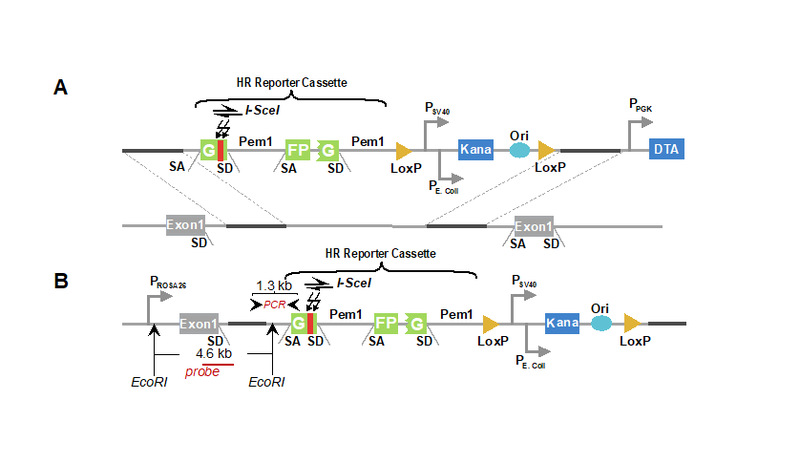
图1 HR检测报告载体
为探究 HR 和 NHEJ 在癌组织中提升的原因,研究团队检测了小鼠癌组织及癌旁组织中DSB修复通路中各蛋白的表达情况,发现:关键修复因子PARP1 和 DNA-PKcs 的表达显著提升。而团队成员利用大量临床标本进一步验证发现:上述两种蛋白在人类HCC中依然呈现明显的表达上调,暗示其在DSB修复的激活和肝细胞癌发展维持中扮演了重要角色。进一步研究显示:利用PARP1 抑制剂olaparib 和 DNA-PKcs 抑制剂NU7441同时处理HCC细胞可以极大地抑制其 HR 和 NHEJ 修复能力。更为重要的是,联合应用olaparib 和NU7441,或同时敲降 PARP1和DNA-PKcs都可协同抑制HCC细胞的增殖,证明二者可作为治疗HCC的潜在靶标。后续的机制研究发现,olaparib 可通过抑制 PARP1酶活,从而阻碍 ALC1 在损伤位点的募集,继而延缓损伤位点周围核小体的清除,最终抑制 RPA2 和 RAD51 在损伤位点的招募。最后,研究团队基于小鼠原位HCC和人HCC PDX模型,进一步证实了olaparib 和 NU7441 联用通过靶向DSB修复以治疗HCC的巨大潜力(图2)。
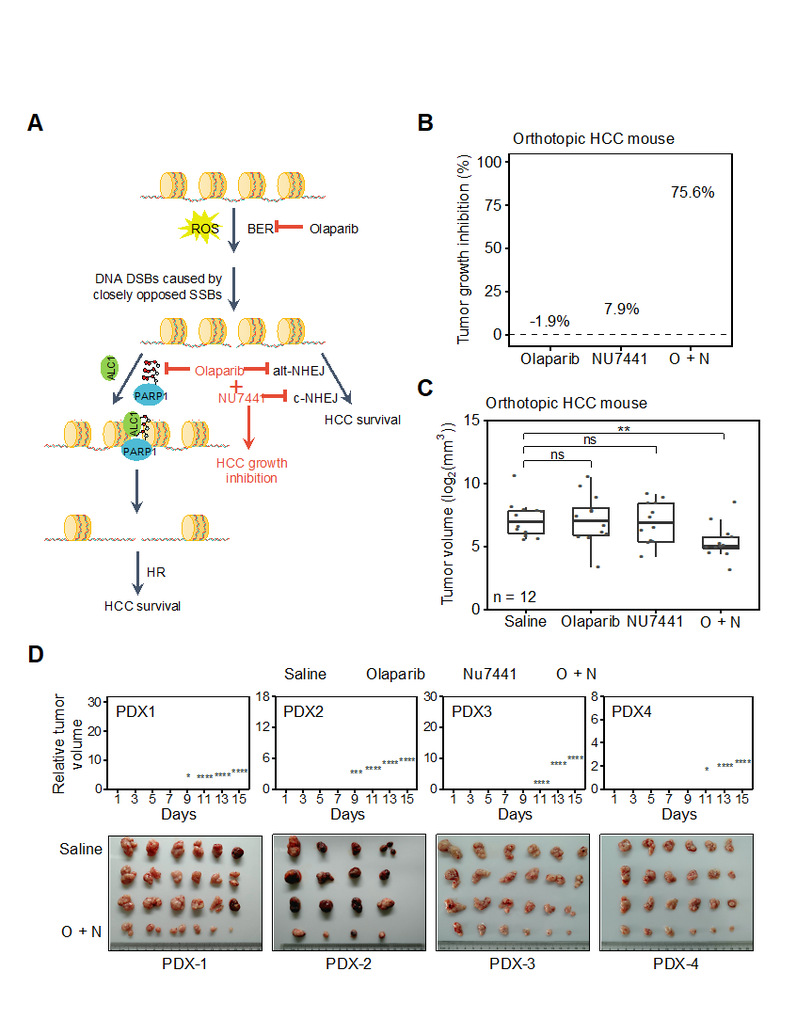
图2 Olaparib和NU7441联合疗法高效抑制HCC
综上所述,该研究团队建立了体内检测肝细胞DSB修复效率的新方法。本项研究中建立的小鼠模型有助于肿瘤、衰老以及其它研究领域深入探索体内环境下DSB变化及其调控机制。此外,该工作发现了导致HCC中DSB能力提升的关键基因 PARP1和 DNA-PKcs,并阐明了HCC中PARP1调控HR的机制。本项研究中olaparib和 NU7441联合疗法的成功临床前应用提示:靶向DSB修复在HCC治疗中具有潜在的临床应用价值。此外,该研究亦拓宽了 PARP1抑制剂在肿瘤治疗中的应用,也为HCC的后续治疗提供了重要的理论基础。
同济大学生命科学与技术学院博士后王晨博士、博士研究生唐欢胤、附属第一妇婴保健院助理研究员耿安珂博士、东方肝胆外科医院戴炳华医生为本文的共同第一作者。同济大学生命科学与技术学院毛志勇教授、孙方霖教授和蒋颖副教授为本文的共同通讯作者。此外,毛志勇教授课题组的多名老师和同学,高绍荣教授课题组的多名老师和同学,同济大学附属第一妇婴保健院万小平教授、贺其志主任,浙江大学药学院朱虹教授,东方肝胆外科医院杨甲梅教授及中南大学附属湘雅医学院谭嵘博士课题组多名成员均参与了该项工作。该研究成果得到国家重点研发计划、国家自然科学基金、上海市优秀学术带头人计划、上海市教委与上海市教育发展基金会“曙光”计划等项目资助。
1. L. A. Torre, F. Bray, R. L. Siegel, J. Ferlay, J. Lortet‐Tieulent, A. Jemal, Global cancer statistics, 2012. Ca Cancer J Clin. 65, 87–108 (2015).
2. S. F. Altekruse, K. A. McGlynn, M. E. Reichman, Hepatocellular Carcinoma Incidence, Mortality, and Survival Trends in the United States From 1975 to 2005. J Clin Oncol. 27, 1485–1491 (2009).
3. N. C. Teoh, Y. Y. Dan, K. Swisshelm, S. Lehman, J. H. Wright, J. Haque, Y. Gu, N. Fausto, Defective DNA strand break repair causes chromosomal instability and accelerates liver carcinogenesis in mice. Hepatology. 47, 2078–2088 (2008).
4. G.-Y. Liou, P. Storz, Reactive oxygen species in cancer. Free Radical Res. 44, 479–496 (2010).
5. H. Gaillard, T. García-Muse, A. Aguilera, Replication stress and cancer. Nat Rev Cancer. 15, 276–289 (2015).
6. A. Vaidya, Z. Mao, X. Tian, B. Spencer, A. Seluanov, V. Gorbunova, Knock-In Reporter Mice Demonstrate that DNA Repair by Non-homologous End Joining Declines with Age. Plos Genet. 10, e1004511 (2014).
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


