Science Advances|李维达/邵振/张振宁团队突破哺乳动物有限的再生能力难题, 通过体内重编程实现高效胰腺原位再生胰岛β细胞并绘制再生图谱
Lancet子刊的一项研究预测,2020~2030年,中国糖尿病医疗费用总费用占GDP的比例将从1.58%增加到1.69%,糖尿病的经济负担增速将超过中国经济增速。糖尿病的巨额医疗支出给患者、家庭及社会带来极为沉重的负担。
胰岛β细胞的缺损是糖尿病的重要致病因素,补充胰岛β细胞是糖尿病治疗的重要环节。通过体内重编程技术实现转分化再生胰岛β细胞为糖尿病的细胞替代疗法提供了新的途径,对于糖尿病的治疗具有重要的临床意义。
胰腺腺泡细胞是胰腺外分泌腺中最丰富的细胞类型,利用重编程技术将胰腺腺泡细胞在体内转分化为胰岛β细胞是一种有效的原位再生胰岛β细胞的方式。Nature上最早报道了小鼠体内的胰腺腺泡细胞在Ngn3、Pdx1和Mafa三个重编程因子(以下简称M3因子)作用下转分化为分泌胰岛素的胰岛β细胞,然而再生效率较低且在体内存在时间短(小于两个月)【相关论文1】。李维达教授在哈佛大学干细胞与再生生物学系博士后期间针对胰腺转分化再生胰岛β细胞效率偏低的技术瓶颈设计了新的串联表达系统,显著地提高了胰腺转分化再生胰岛β细胞的效率,在哺乳动物体内通过转分化原位高效再生了可以长期稳定存在并有效逆转糖尿病小鼠模型的高血糖症状的胰岛β细胞,通过不同重编程因子的组合把胰腺腺泡细胞转分化为胰岛中的三种主要内分泌细胞类型(α细胞、β细胞及δ细胞),转分化再生的胰岛细胞具有和内源胰岛细胞相似的结构和功能,并可以调节糖尿病小鼠高血糖症状(图1)。相关工作以第一作者发表于Nature Biotechnology及eLife【相关论文2,3】。
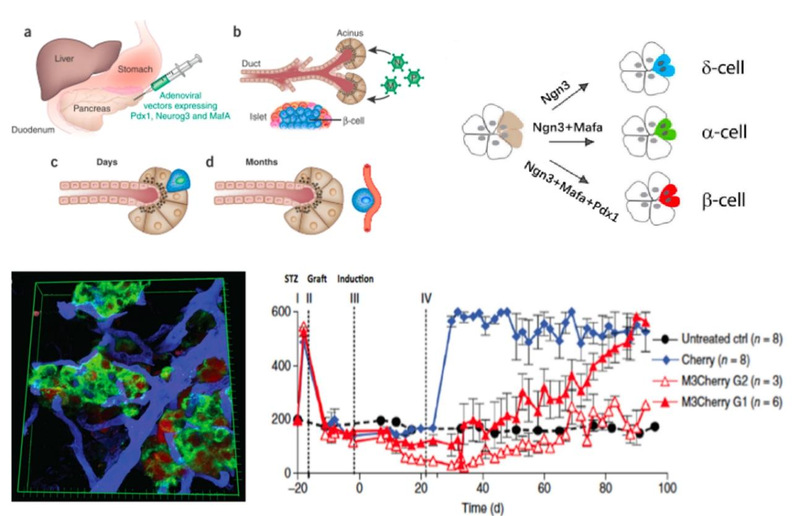
图1. 体内原位转分化再生三种内分泌细胞并改善糖尿病小鼠高血糖症状
在此工作的基础上,2023年5月24日,同济大学李维达教授团队与中科院上海营养与健康研究所邵振研究员团队合作,实现了高效胰腺在体转分化机制的揭示,在Science Advances期刊发表题为:Charting a high-resolution roadmap for regeneration of pancreatic β cells by in vivo transdifferentiation from adult acinar cells的研究论文(图2)【相关论文4】。

图2. 文章截图
在成年小鼠体内胰腺腺泡细胞中过表达M3因子,可以快速高效地再生出表达胰岛素(Insulin)的β细胞(图3A)。本研究以M3因子诱导成年小鼠体内胰腺腺泡细胞转分化为β细胞的再生过程为研究模型,应用单细胞转录组学,描绘了体内胰岛β细胞再生前10天转录组动态演变的高精度分子路径。通过聚类分析和细胞命运轨迹构建,发现细胞命运重塑轨迹在初始阶段是线性的。随后细胞命运轨迹分为两个分支,其中一个分支的端点为诱导的β细胞,另一个分支的端点为转分化失败的“死胡同”(Dead-end)状态(图3B)。
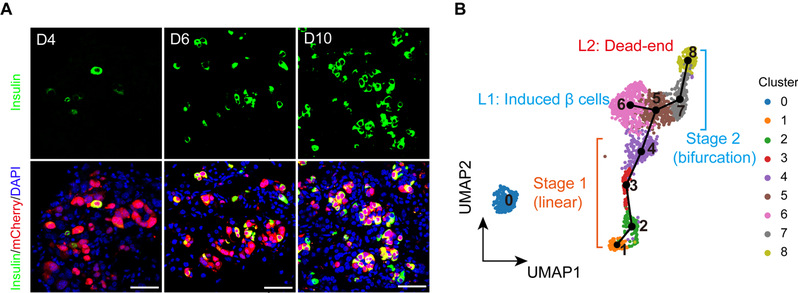
图3. 通过体内重编程再生胰岛β细胞
基于构建的细胞命运演变轨迹,对不同阶段细胞的分子特征进行深入分析。在初始阶段,M3因子诱导p53瞬时上调;同时发现p53纯合缺失小鼠体内由M3因子诱导再生而来的β细胞比例显著增加。随后,通过比较细胞命运分支终点细胞群(C6和C8)间的差异表达基因,发现DNA甲基化转移酶编码基因Dnmt3a在转分化失败的Dead-end中显著高表达。为了系统研究Dnmt3a的角色,通过shRNA敲降Dnmt3a的表达,发现第10天M3+shDnmt3a组的再生细胞比例显著高于M3组。相反的实验证明,M3与Dnmt3a同时过表达后能够显著降低再生细胞比例。综上所述,本研究发现p53和高表达的Dnmt3a在体内转分化过程中扮演重编程壁垒的角色(图4)。通过该体内转分化模型,研究者破译了哺乳动物体内胰岛β细胞再生的高分辨率转录组路径图,拓宽了胰岛β细胞转分化再生来源,实现新的基于细胞多来源转分化再生胰岛β细胞的途径,为糖尿病的治疗提供新思路,并提供了促进哺乳动物再生的参考蓝图,具有重要的转化前景。
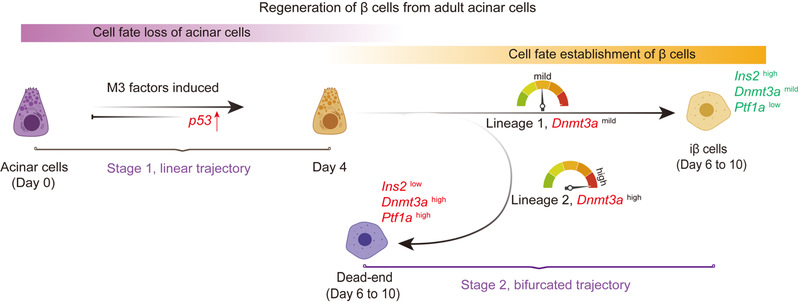
图4. M3因子诱导体内胰岛β细胞再生分子路径示意图
补充缺损的胰岛β细胞是治疗糖尿病的关键一环。哺乳动物的再生能力极为有限,而通过体内重编程技术实现转分化,为胰岛β细胞的再生提供了新的途径,具有以下优势:1. 与诱导分化途径经过多能干细胞阶段的细胞替代疗法相比,基于转分化的细胞疗法规避了移植后形成畸胎瘤的风险,具有更高的安全性;2. 直接胰腺原位再生的胰岛β细胞可以借助体内的微环境更加成熟,并排除移植手术带来的风险;3. 体内转分化原位再生的胰岛β细胞属于自体细胞,因此可以规避免疫抑制剂的使用。通过体内重编程技术实现转分化再生胰岛β细胞为糖尿病的细胞疗法提供了有效途径,该工作为临床转化打下了坚实基础,具有重要的临床意义和应用前景。李维达教授团队与临床科室紧密合作,积极寻求优质科研成果到临床应用的高效转化。
同济大学附属东方医院再生医学研究所、教育部“细胞干性与命运编辑”前沿科学中心、同济大学生命科学与技术学院李维达教授、张振宁副教授及中国科学院上海营养与健康研究所邵振研究员为本文共同通讯作者。同济大学博士生刘刚、中国科学院上海营养与健康研究所博士生李雅娜及美国宾夕法尼亚州立大学李木山为本文共同第一作者。该项研究得到了科技部重点研发计划、上海市科委重点项目等项目资助。此外,衷心感谢施威杨教授及张腾娇博士在单细胞文库构建过程中给予的支持和帮助!
相关论文:
1. Zhou Q, Brown J, Kanarek A, Rajagopal J, Melton DA. In vivo reprogramming of adult pancreatic exocrine cells to beta-cells. Nature. 2008 Oct 2;455(7213):627-32.
2. Li W*, Cavelti-Weder C*, Zhang Y*, Clement K, Donovan S, Gonzalez G, Zhu J, Stemann M, Xu K, Hashimoto T, Yamada T, Nakanishi M, Zhang Y, Zeng S, Gifford D, Meissner A, Weir G, Zhou Q. Long-term persistence and development of induced pancreatic beta cells generated by lineage conversion of acinar cells. Nat Biotechnol. 2014 Dec;32(12):1223-30.
3. Li W*, Nakanishi M*, Zumsteg A, Shear M, Wright C, Melton DA, Zhou Q. In vivo reprogramming of pancreatic acinar cells to three islet endocrine subtypes. eLife. 2014 Jan 1;3:e01846.
4. Liu G*, Li Y*, Li M, Li S, He Q, Liu S, Su Q, Chen X, Xu M, Zhang ZN#, Shao Z#, Li W#. Charting a high-resolution roadmap for regeneration of pancreatic β cells by in vivo transdifferentiation from adult acinar cells. Sci Adv. (Online)
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


