Advanced Science | 何志颖团队揭示移植肝细胞重编程及再生肝脏的调控机制
肝衰竭是全球重大致死性肝病终点,肝细胞移植作为肝再生治疗的核心手段,可有效改善肝衰竭患者预后,但移植成熟肝细胞的再生调控机制长期不明确,严重制约了临床转化效率。成熟肝细胞在损伤微环境中的可塑性调控、增殖与代谢功能的平衡机制,以及宿主微环境对供体细胞命运的调控网络,是当前肝再生领域亟待解决的关键科学问题。
2026年1月29日,同济大学生命科学与技术学院、附属东方医院再生医学研究所何志颖教授团队在Advanced Science发表题为“Conversion of Transplanted Mature Hepatocytes into Afp⁺ Reprogrammed Cells for Liver Regeneration after Injury”的研究论文。该研究综合运用连续移植、谱系追踪、单细胞转录组测序(scRNA-seq)和单细胞染色质可及性测序(scATAC-seq)等技术,首次系统阐明移植成熟肝细胞通过重编程为过渡性甲胎蛋白阳性重编程肝细胞(Afp⁺ rHeps),进而高效驱动肝脏再生修复的细胞命运转变过程与核心调控网络。

研究团队以Fah⁻/⁻肝衰竭小鼠模型为研究体系,移植的成熟肝细胞可快速定植、增殖并完全重建Fah⁻/⁻小鼠肝脏结构与功能。通过两轮连续移植结合单细胞测序分析,团队发现移植后早期(1-3周),供体肝细胞发生广泛转录组重塑,形成一个独特的过渡细胞群体(Group1)。这群细胞高表达Afp、H19等肝前体细胞标志物,同时激活细胞周期和代谢重编程相关通路,展现出强大增殖潜能,研究者将其定义为 Afp⁺重编程肝细胞(Afp⁺ rHeps)。
深入分析表明,Afp⁺ rHeps在转录谱上部分类似于未成熟肝细胞,但不同于胆道损伤模型中产生的双向潜能的肝前体样细胞(LPLCs),它们保持着向成熟肝细胞分化的单潜能性,不表达胆管细胞标志物。研究进一步揭示了Afp⁺ rHeps内部的异质性:根据Afp表达水平可划分为 Afplow 和 Afphigh 两个功能亚群。Afplow细胞具有高增殖活性,其代谢特征表现为增强的糖酵解、三羧酸循环和氧化磷酸化,为快速扩增提供能量和生物合成前体;而Afphigh细胞则倾向于脂肪酸β-氧化(该表型在再生微环境中受PPARγ信号轴的整体驱动)和解毒代谢,并伴随细胞周期抑制,从而适应损伤微环境中的应激压力。这种“代谢-增殖耦合”的分工协作,是Afp⁺ rHeps高效实现肝脏修复的重要基础。
在机制研究方面,团队取得了两项相互关联的突破性发现。首先,研究证实了AFP-PPARγ代谢轴在肝脏再生中的核心驱动作用。以往被视为生物标志物的甲胎蛋白(AFP),在本研究中被揭示为肝脏再生的核心效应因子。它在细胞内构建了一个以PPARγ信号为中心的转录-代谢调控网络,通过驱动脂肪酸氧化、三羧酸循环和氧化磷酸化的级联激活,为肝细胞适应损伤环境、执行修复功能提供了关键的代谢支持。功能实验表明,重组AFP治疗不仅能显著增强移植肝细胞的定植能力,还在CCl₄和APAP诱导的急性肝损伤模型中展现出强大的肝保护作用;而使用PPARγ拮抗剂则可完全阻断AFP的促修复效应,反向验证了该轴线的必要性。
其次,研究首次揭示了中性粒细胞-TNF-α/AP-1有丝分裂信号轴的关键激活作用。宿主肝脏内浸润的中性粒细胞被鉴定为驱动再生的关键“利基”细胞。它们通过分泌TNF-α,与移植肝细胞上高表达的TNFR1受体结合,进而激活AP-1转录因子模块,上调Ccnd1、Mki67等细胞周期基因,从而特异性驱动高增殖潜能的Afplow亚群细胞分裂。同时,中性粒细胞共递送的抑瘤素M(OSM)信号有助于维持肝细胞的上皮身份。体内实验证实,抑制AP-1可严重削弱移植肝细胞的再生能力,明确了该通路在增殖调控中的不可或缺性。
此外,研究还揭示了移植肝细胞的有序再生模式:通过上皮-间质可塑性(EMP)启动迁移,逐步占据损伤区域,其分子分区的重建受PPAR等代谢信号时空调控,形成“迁移先于分区适应”的空间调控规律,确保肝脏功能的逐步恢复与稳定。
这项研究完整描绘了移植成熟肝细胞在体内再生过程中的动态命运转变图谱,并揭示了 AFP-PPARγ代谢轴与中性粒细胞-TNF-α/AP-1信号轴这两个协同的核心调控机制。跨模型与跨物种验证显示,该核心程序在人类急性肝衰竭中同样激活,证实了其临床相关性。这些发现不仅深化了对肝脏再生生物学本质的理解,更为优化肝细胞移植疗法提供了清晰的双靶点策略:通过靶向PPARγ/AFP轴增强移植细胞的代谢适应与存活,同时调控局部免疫微环境以安全促进其增殖,从而为协同提升终末期肝病的治疗疗效开辟了新路径。
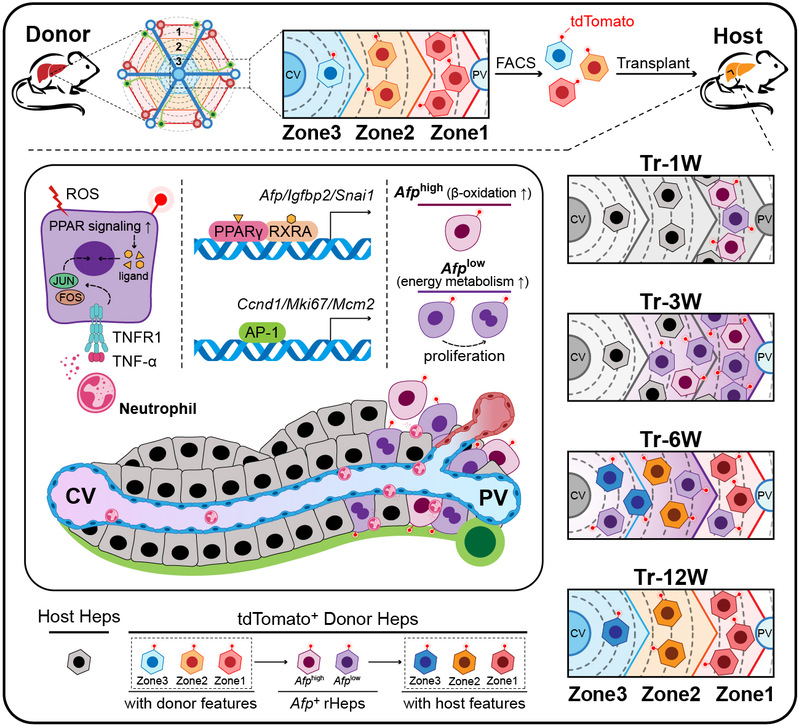
移植肝细胞经 “代谢-免疫” 双轴调控重编程为 Afp⁺ rHeps 并驱动肝脏分区重建
同济大学生命科学与技术学院、附属东方医院再生医学研究所何志颖教授、张文成研究员为本文共同通讯作者;同济大学生科院博士研究生方婷、杨超,南昌大学第一附属医院邱华、杜源为共同第一作者。该研究得到国家自然科学基金、科技部重点研发计划、上海市科委项目、上海干细胞转化医学工程技术研究中心及上海市高峰学科建设项目的联合资助。
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


