J Adv Res|林昶东课题组系统综述椎间盘退变中的病理力学机制与靶向干预策略
全球范围内,腰痛的高发病率(约1/13)使其成为造成社会医疗负担的主要疾病之一,而椎间盘退变则是其关键的病理解剖学基础。髓核位于椎间盘中央,具有高度水化和显著的力学敏感性,是承受和分配脊柱负荷的关键结构,也是最早发生退变的区域。虽然既往流行病学和影像学研究明确了机械过载、反复弯曲及长期异常应力与椎间盘退变密切相关,但宏观层面的脊柱运动转化为微观病理信号的生物力学转导过程,及其诱导髓核细胞功能衰退的级联反应仍亟待深入探索。因此,基于病理力学框架探究髓核细胞感应并转导异常机械应力的机制,是破解椎间盘退变发生、发展机制的关键环节。
近日,同济大学生命科学与技术学院/附属养志康复医院林昶东课题组联合苏州大学附属苏州九院骨科言湛军主任团队以及苏州大学附属第一医院骨科杨惠林主任团队在国际知名学术期刊《高级研究杂志》(Journal of Advanced Research)在线发表了题为“Decoding intervertebral disc degeneration pathomechanics: from mechanisms to therapeutic horizons”的综述论文。该文从生物力学与细胞力学生物学的整合视角,深入探讨了椎间盘核心结构——髓核在退变过程中的病理力学演进。通过系统分析异常机械应力如何介导髓核细胞稳态的破坏及其驱动退行性病变的分子机制,阐明了力学信号转导在椎间盘退变中的核心作用,为探索新型力学干预疗法奠定了理论基础。

该项工作对椎间盘退变的病理生理结构进行了系统解构,并对比分析了多尺度力学模拟平台的优劣。研究涵盖了整体脊柱水平的动物模型、离体椎间盘器官模型及微观细胞力学体系,确立了一个跨尺度的病理力学评价体系。文章指出,各模型对临床病理表型的模拟侧重点不同,例如:尾椎压缩及腰椎不稳模型能精准模拟慢性力学失衡引发的缓慢演进过程,适合研究长期力学失衡引发的退行性变化;相比之下,穿刺模型则是研究急性物理损伤触发退行性病变的理想手段。
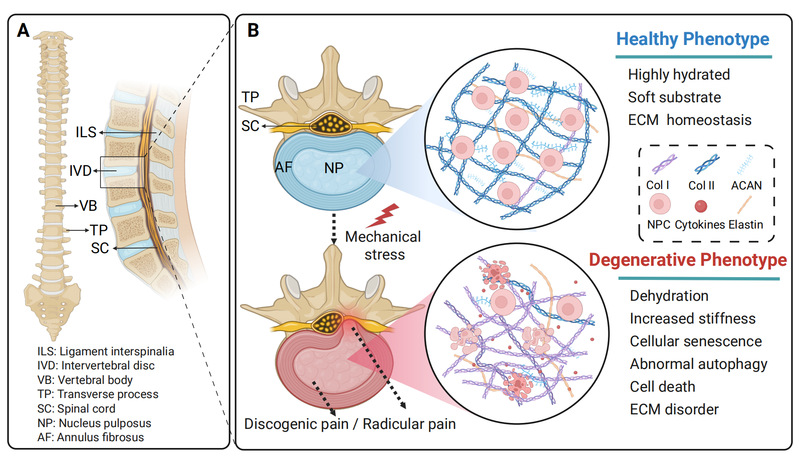
椎间盘退变病理生理学示意图
在此基础上,作者进一步分析了组织层面的力学变化如何重塑髓核细胞所处的微环境。异常压缩、反复弯曲或长期负荷可导致髓核脱水、基质力学性能改变以及应力分布不均,从而使细胞暴露于异常的静水压、剪切力和基质刚度条件中。研究强调,椎间盘退变并非单一力学刺激的结果,而是多种机械因素在时间和空间上的叠加效应。这一从宏观到微观的力学转换视角,为理解临床上“无明显结构损伤却持续进展的退变过程”提供了重要解释。
其次,该综述系统整合了不同类型机械刺激对髓核细胞生物学行为的影响机制,重点围绕脊索细胞稳态改变、髓核细胞衰老、自噬失衡、多种形式的细胞死亡以及细胞外基质重塑展开。研究显示,异常压缩和基质刚度升高可通过整合素、Piezo1、TRPV4等机械敏感离子通道蛋白启动力学信号转导,进而影响线粒体功能、氧化还原稳态以及细胞骨架张力分布。该项工作进一步指出,力学刺激并非简单“有害”或“有益”,而是呈现明显的强度与频率依赖性。生理范围内的周期性机械刺激有助于维持能量代谢与基质合成,而持续、高强度或静态负荷则可诱导线粒体损伤、活性氧积累以及炎症信号激活,推动细胞进入衰老或死亡程序。值得注意的是,不同力学条件下,髓核细胞可表现出凋亡、坏死性凋亡、焦亡或铁死亡等不同死亡模式,提示力学微环境在细胞命运选择中具有决定性作用。同时,作者强调病理力学信号通过多条通路并行作用,最终导致髓核细胞稳态网络的整体崩塌,而非依赖单一分子事件。
研究重点强调了细胞外基质在病理力学中的双重角色——既是机械刺激的来源,也是退变进程的放大器。正常情况下,富含蛋白聚糖和Ⅱ型胶原的髓核基质具有高度水化和良好的缓冲性能,有助于分散轴向负荷并维持细胞稳态。然而,在异常力学刺激下,基质降解酶表达上调,蛋白聚糖丢失,胶原组成发生改变,导致基质逐渐硬化并呈现纤维化特征。这种基质刚度升高不仅是退变的结果,更会反过来强化病理力学信号。硬化的基质改变了细胞对力学刺激的感知方式,增强机械敏感通路的激活程度,从而进一步抑制基质合成、促进分解代谢,形成“力学失衡—基质重塑—信号放大”的恶性循环。作者通过整合多项体内外研究,明确提出细胞外基质力学性质变化是连接宏观力学刺激与细胞退变的重要枢纽。这一观点为理解椎间盘退变的持续进展性提供了关键机制基础,也提示单纯针对炎症或代谢的干预难以逆转退变,必须同时考虑力学环境的整体重塑。
最后,在文章的展望部分,作者进一步从力学生物学视角对椎间盘退变中的机械信号转导过程进行了系统概括,将其概括为三个相互衔接的阶段,并分别对应当前椎间盘生物力学领域亟待解决的关键科学问题。第一阶段关注宏观力学负荷如何转化为髓核微环境中的微观机械刺激,即脊柱运动、压缩和弯曲等宏观力学变化,如何通过水分交换、基质重排和力学分布不均,最终作用于细胞层面;第二阶段聚焦髓核细胞对机械信号的感知与转导,重点讨论整合素、机械敏感离子通道及细胞骨架等结构在机械信号捕获与放大中的作用机制;第三阶段则指向细胞内信号网络如何将机械刺激转化为稳定或病理性的生物学响应,包括基因转录调控、代谢重编程等。基于这三个阶段框架,文章进一步提出了针对性的干预思路,包括通过优化力学节律的康复训练调控宏观负荷,通过靶向机械感受分子干预信号转导,以及利用具备可调力学性能的生物材料重塑局部微环境。该理论框架为理解椎间盘退变的力学本质及发展机制提供了清晰路径,也为机制导向的精准干预策略奠定了基础。
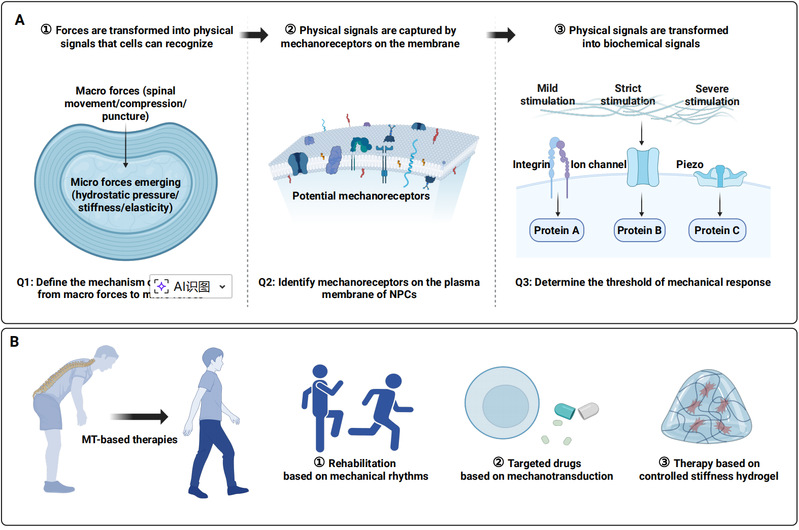
椎间盘生物力学转导过程及对应的机械转导干预策略
同济大学生命科学与技术学院/附属养志康复医院林昶东研究员和苏州大学附属苏州九院骨科言湛军主任以及苏州大学附属第一医院骨科杨惠林主任为本文的共同通讯作者。同济大学生命科学与技术学院2025级博士研究生乔翰林为本文的第一作者。经费支持来自国家自然科学基金、上海市“科技创新行动计划”自然科学基金、东方英才青年项目、国家临床重点专科建设项目、上海市康复医学重中之重研究中心、上海市残联智能康复辅助器具与技术重点实验室、中央高校基本科研业务费专项资金和干细胞与转化IV类高峰学科等。
文章链接:https://www.sciencedirect.com/science/article/pii/S2090123226000706?via%3Dihub
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


