Journal of Medicinal Chemistry|杨静团队联合研究通过化学蛋白质组学发现新型GSTO1共价抑制剂
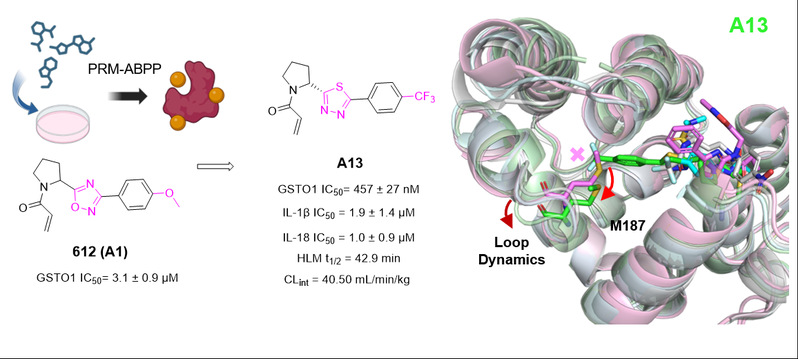
谷胱甘肽S-转移酶(GSTs)家族是维持细胞氧化还原平衡的关键蛋白。其中,非典型亚型GSTO1不仅参与氧化还原反应,还在信号转导和炎症调控中发挥重要作用。现有抑制剂如C1-27虽具有一定抗炎活性,但其氯乙酰胺弹头反应性强、代谢稳定性差,限制了进一步开发。因此,寻找反应更温和、成药性更优的新型共价抑制剂成为研究焦点。
近日,同济大学生命科学与技术学院杨静教授团队联合临港实验室陆文超研究员团队、南京科络思生物研发团队,在药物化学领域权威期刊 Journal of Medicinal Chemistry 上发表了题为“Discovery of Potent, Allosteric GSTO1 Covalent Inhibitors with a New Binding Mode”的研究论文。该研究利用平行反应监测(PRM)靶向质谱技术,从一个共价片段库中筛选出靶向GSTO1的苗头化合物,并通过系统优化,获得了高选择性、代谢稳定且作用机制独特的共价抑制剂A13。这项工作不仅揭示了GSTO1在炎症调控中的关键作用,也展现了化学蛋白质组学在共价药物发现与先导化合物优化中的强大应用潜力。

研究团队利用自建的共价片段化学蛋白质组学平台,从内部电亲性片段库中筛选出丙烯酰胺类化合物A1,发现其可共价结合GSTO1蛋白的Cys32残基。与通常稳定蛋白的DSF结果相反,A1显著降低GSTO1热稳定性,提示其可能通过变构机制诱导构象变化。经构效关系优化,获得衍生物A13,其共价结合效率优异(kinact/KI = 226 M⁻¹·s⁻¹),且在人肝微粒体中代谢稳定。高分辨率晶体结构(PDB:9LHF)显示,A13结合于一个由Trp222、Arg183和Met187构成的新型疏水变构口袋,其4-三氟甲基苯环引起Met187位移,驱动蛋白构象重塑,为后续抑制剂设计提供了结构基础。
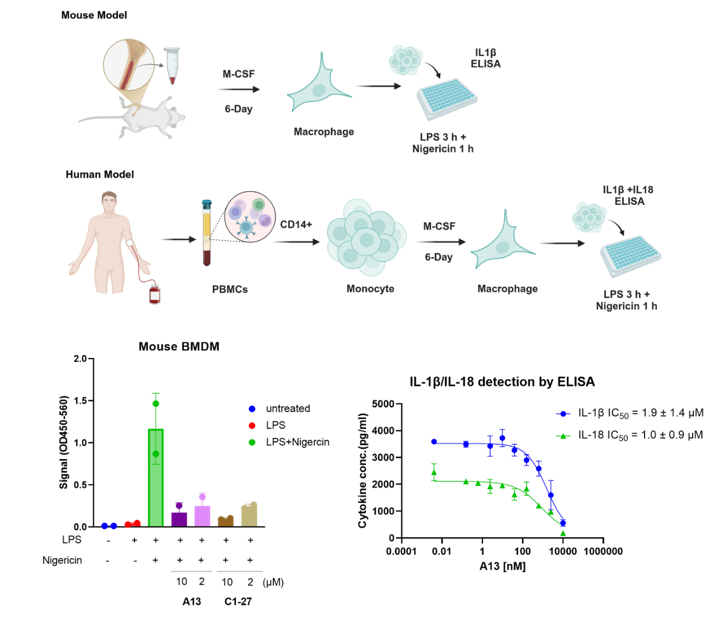
研究团队进一步通过细胞水平验证与机制探究,证实了A13的作用靶点及功能特征。在HEK293T细胞中,CETSA热稳定性实验与CMFDA荧光探针标记实验均表明,A13能够在细胞内稳定结合并占据GSTO1的活性位点。与此同时,团队合成了A13衍生物的炔基探针,通过Click–Pulldown结合质谱鉴定手段,验证了A13在全蛋白质组水平上的共价结合选择性,为其分子靶点确认提供了有力证据。在功能层面,A13对炎症信号通路展现出显著调控作用:在巨噬细胞模型中,A13处理可明显抑制LPS/Nigericin诱导的IL-1β和IL-18分泌,半抑制浓度(IC₅₀)分别为1.9 μM和1.0 μM,显示出优异的抗炎活性本研究整合PRM质谱筛选、结构解析与化学优化,形成了从苗头化合物发现到机制阐明的完整研究体系。A13可作为探究GSTO1功能的化学探针,也为针对GSTO1的共价药物开发提供了新方向。
同济大学杨静教授,临港实验室陆文超青年研究员,科络思生物创始人兼CEO陈南研究员为论文的共同通讯作者。同济大学博士后周立昕,上海科技大学博士研究生孙彦丽,科络思生物有限公司张丰盈研究员为文章共同第一作者。该研究受到上海市浦江人才计划(23PJ1430100)和临港国家实验室基金支持。
论文链接: https://pubs.acs.org/doi/10.1021/acs.jmedchem.5c01724
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


