Cancer Research | 王海芸/俞作仁团队联合发现心理压力促进乳腺癌肺转移新机制
乳腺癌是全球女性最常见的恶性肿瘤,其死亡率主要归因于肿瘤转移。除了年龄、遗传、激素水平等传统风险因素外,心理压力已被广泛认为是影响乳腺癌进展与预后的重要因素。然而,压力如何影响乳腺癌的远处转移,尤其是肺转移,其机制尚不明确。中性粒细胞作为先天免疫系统的重要组成部分,在肿瘤微环境中表现出高度的功能可塑性,但其在压力诱导的转移过程中作用仍知之甚少。

近日,同济大学医学院、附属东方医院俞作仁教授与生命科学与技术学院王海芸教授团队在《Cancer Research》 期刊发表了题为 《Stress Promotes Lung Metastasis in Breast Cancer by Altering Neutrophil Differentiation》 的研究论文。该研究首次揭示慢性心理压力通过诱导肺部一种新型“癌症应激启动型中性粒细胞(CSP neutrophils)”,促进乳腺癌肺转移的分子机制。研究进一步明确了CCL3/CCL4-CCR1趋化轴在该过程中的关键作用,为预防和治疗乳腺癌肺转移提供了新的潜在靶点。
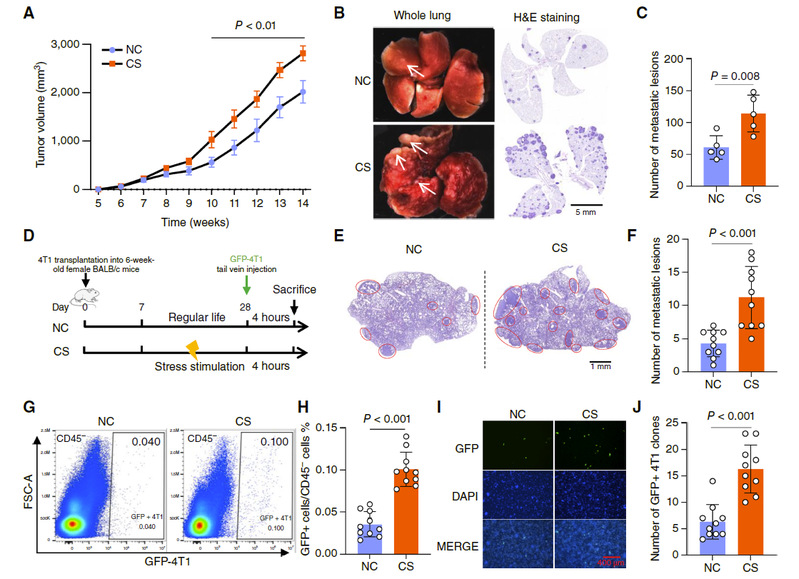
图1 CS促进乳腺癌小鼠模型中的肺转移
研究团队利用转基因小鼠模型(MMTV-PyMT)和移植瘤模型(4T1细胞),对小鼠施加慢性不可预测压力刺激。结果显示,压力不仅加速原发肿瘤生长,还显著促进乳腺癌细胞向肺部的转移(图1)。通过对转移前肺组织进行单细胞RNA测序分析,研究人员发现压力诱导了一类之前未被认识的中性粒细胞亚群——Neu_CSP。该类细胞高表达Ccl3、Ccl4、Cxcl2、Il1r2和Cebpb等基因。轨迹分析进一步表明,慢性压力使肺部的中性粒细胞从Neu_CP(癌症启动型) 亚型向Neu_CSP亚型转化(图2)。
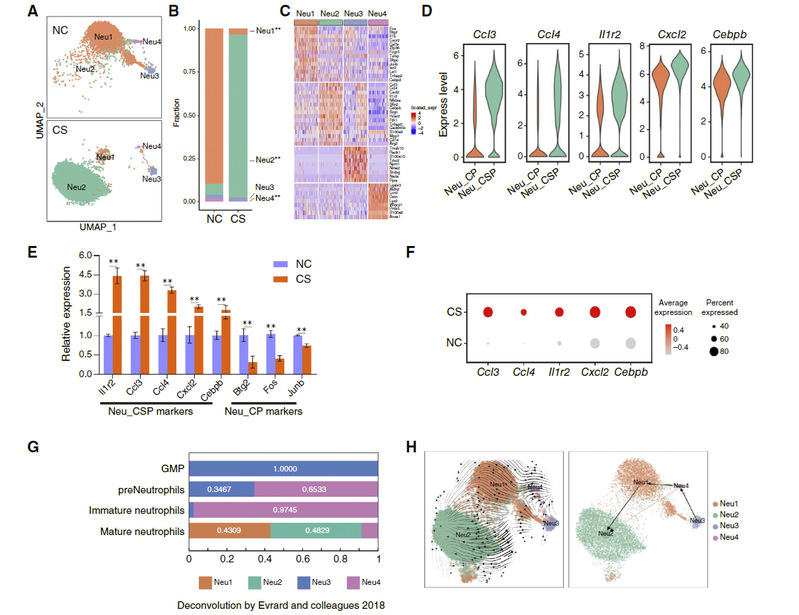
图2 CS诱导肿瘤小鼠肺中性粒细胞亚型改变
机制上,压力激素皮质酮通过激活糖皮质激素受体NR3C1,上调转录因子C/EBPβ的表达,进而直接结合并促进Ccl3和Ccl4的转录。这些由Neu_CSP中性粒细胞分泌的趋化因子CCL3/CCL4,通过与其受体CCR1结合,特异性地招募CCR1高表达的乳腺癌细胞向肺部归巢,从而促进转移形成。研究团队通过多种干预手段验证了这一通路的重要性:使用抗Ly6G抗体清除中性粒细胞;利用CRISPR/Cas9技术条件性敲除中性粒细胞中的Ccl3/Ccl4;使用小分子抑制剂BX471阻断乳腺癌细胞上的CCR1。上述任一策略均能显著抑制压力诱导的乳腺癌肺转移。此外,临床数据分析显示,CCR1高表达的乳腺癌患者无进展生存期更短,更易发生远处转移。
该研究不仅首次揭示了“压力→中性粒细胞→肺癌转移”的调控轴(图3),还为未来开发针对CSP中性粒细胞或CCR1+乳腺癌细胞的干预策略提供了理论依据。阻断CCL3/CCL4-CCR1信号通路,有望成为预防或治疗乳腺癌肺转移的新方向。
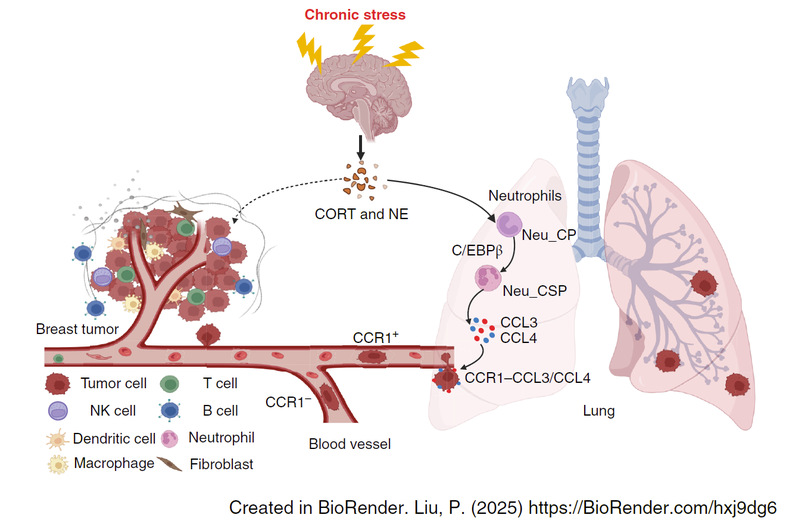
图3 调控机制示意图
论文第一作者为同济大学医学院博士研究生刘鹏飞、生命科学与技术学院博士研究生郑杰、医学院博士研究生马文静,通讯作者为同济大学医学院、附属东方医院俞作仁教授和生命科学与技术学院王海芸教授。该研究得到了国家自然科学基金和上海市浦东新区卫生健康委员会青年医学人才培养计划的资助。
原文链接:https://doi.org/10.1158/0008-5472.CAN-25-1763
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


