Aging Cell|薛雷团队揭示阿尔茨海默病中神经轴突退变的新机制
2025年11月23日,同济大学生命科学与技术学院薛雷教授团队在国际知名期刊《Aging Cell》上发表了题为“APP Induces AICD-Mediated Autophagy-Dependent Axon Degeneration”的研究论文。该研究首次揭示了阿尔茨海默病关键蛋白APP通过其胞内结构域AICD,而非传统认为的Aβ,诱发年龄依赖性神经轴突退变的分子机制,并明确了自噬通路及下游dFoxO/Snail-Atg1轴在其中扮演的关键角色。这一发现为深入理解阿尔茨海默病的发病机制及开发新的治疗策略提供了重要理论依据和潜在靶点。

阿尔茨海默病(AD)是一种与年龄相关的神经退行性疾病,其病理特征包括细胞外老年斑、细胞内神经纤维缠结和神经元功能障碍。淀粉样前体蛋白在AD病理生理过程中扮演核心角色。长期以来,Aβ的产生被认为是AD发病的主要原因,但针对Aβ的临床治疗试验效果有限。APP切割产生的另一个重要片段—APP胞内结构域(AICD)的功能在AD中的作用尚不清楚。
研究团队在果蝇翼神经元中特异性表达人源APP,成功构建了能够模拟AD相关轴突退变的新模型。发现APP的表达会引发年龄依赖性的轴突退化;这种退化不依赖于Aβ,而是依赖于AICD;AICD的单独过表达就足以诱导轴突退化;抑制细胞凋亡不能缓解APP/AICD引起的轴突破坏,但通过敲降自噬关键基因或使用自噬抑制剂氯喹,则能有效阻止轴突退化,表明该过程是自噬依赖性的。为进一步阐明机制,团队发现转录因子FoxO是APP/AICD诱导自噬和轴突退化所必需的。敲低FoxO或其互作蛋白Snail (Sna),均可抑制APP/AICD引发的自噬和轴突损伤。同时,AICD过表达会上调FoxO及其下游自噬起始基因Atg1的表达。功能实验证实,敲低Atg1能减轻APP/AICD诱导的轴突退化,而过表达Atg1即可引发轴突退化。这些结果共同揭示了 APP/AICD → FoxO/Sna → Atg1 → 自噬 → 轴突退化 这一完整的信号通路。
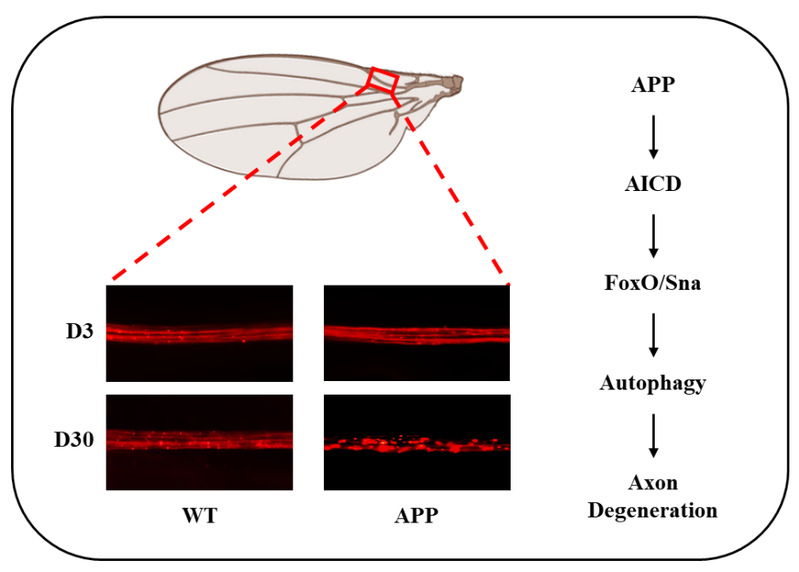
该研究不仅揭示了AICD在AD轴突病理中的关键作用,还明确了自噬通路作为潜在的干预环节。特别值得注意的是,使用临床上已应用的自噬抑制剂氯喹进行处理,能够有效缓解APP或AICD诱导的轴突退化,这为AD的治疗提供了新的思路和候选策略。
同济大学生命科学与技术学院研究生、邱宇和潘煜为本文共同第一作者。同济大学生命科学与技术学院/附属第十人民医院薛雷教授和博士后李成琳为共同通讯作者。同济大学附属第十人民医院核医学科吕中伟教授,同济大学生命科学与技术学院李文哲副教授,研究生徐瑞宏、孙仪、孙艺昊和庄璐铭等也参与了该工作。该研究获得了国家自然科学基金、上海市科学技术委员会及中国博士后科学基金等项目资助。
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


