Nature Cell Biology|刘文强/高绍荣/江赐忠团队揭示围着床期胚胎二价染色质动态重塑的开关
2025年10月1日,同济大学高绍荣教授、刘文强教授与江赐忠教授团队合作在 Nature Cell Biology发表研究论文,题为“Remodeling bivalent chromatin is essential for mouse peri-implantation embryogenesis”。该研究系统描绘了小鼠围着床期二价染色质的动态重塑过程,揭示了其在胚层谱系特化和多能性退出中的关键作用,并发现了一类短暂维持的瞬时二价状态(Transient Bivalency, TB)。研究团队还鉴定出转录因子 ZBTB17 是驱动瞬时二价修饰解离的核心因子,从而揭示了表观遗传“时钟”在早期胚胎细胞命运决定中的关键机制。

在哺乳动物胚胎发育过程中,围着床期是决定胚胎谱系命运和妊娠建立的关键阶段,也是人类胚胎发生停育或流产的高发期。此时,胚胎通过高度协调的细胞增殖、迁移和谱系特化,从多能性逐步转向谱系特异性状态。在这一过程中,表观遗传调控,尤其是二价组蛋白修饰(bivalent histone modification),发挥了核心作用。
所谓二价修饰,是指同一基因启动子上同时存在激活型组蛋白修饰H3K4me3和抑制型组蛋白修饰H3K27me3的特殊染色质状态,这一状态最初在多能干细胞中被发现,广泛分布于发育关键基因启动子区,使基因保持“蓄势待发(poised)”状态:既避免过早激活,又为后续分化信号响应做好准备[1]。高绍荣教授团队之前的研究表明,在早期胚胎中二价修饰在植入前囊胚阶段开始建立但强度较弱,随后的研究报道中在原肠胚时期会强化为“超二价(Super-bivalency)”模式,从而显著提高基因调控的时空精确性[2, 3]。
然而,围着床期胚胎中二价修饰的建立、维持与解离机制仍不明确:它如何在谱系命运决定中有序重组?是否参与多能性退出与谱系程序的启动?以及其精确调控机制由何驱动?这些问题一直是该领域的核心问题。
研究人员通过整合荧光谱系示踪、体内外胚胎分离与多组学联合分析策略发现,在上胚层(EPI)形成过程中,H3K27me3的重编程幅度远高于H3K4me3。二价修饰启动子与H3K27me3整体动态同步波动,在E4.5时于EPI中达到峰值;相比之下,内胚层(PE)中的二价信号始终较弱。进一步分析表明,二价修饰以谱系特异性方式建立于上胚层和内胚层特化过程中,其修饰偏向性(H3K4me3偏向型或H3K27me3偏向型)可有效预测基因的转录命运:谱系命运决定起始时,异谱系基因(如EPI中的内胚层特异性基因)倾向于获得H3K27me3偏向型二价修饰,伴随Pol II结合减少和转录抑制;本谱系基因则获得H3K4me3偏向型二价修饰,同时增强Pol II招募和基因激活 (图1)。
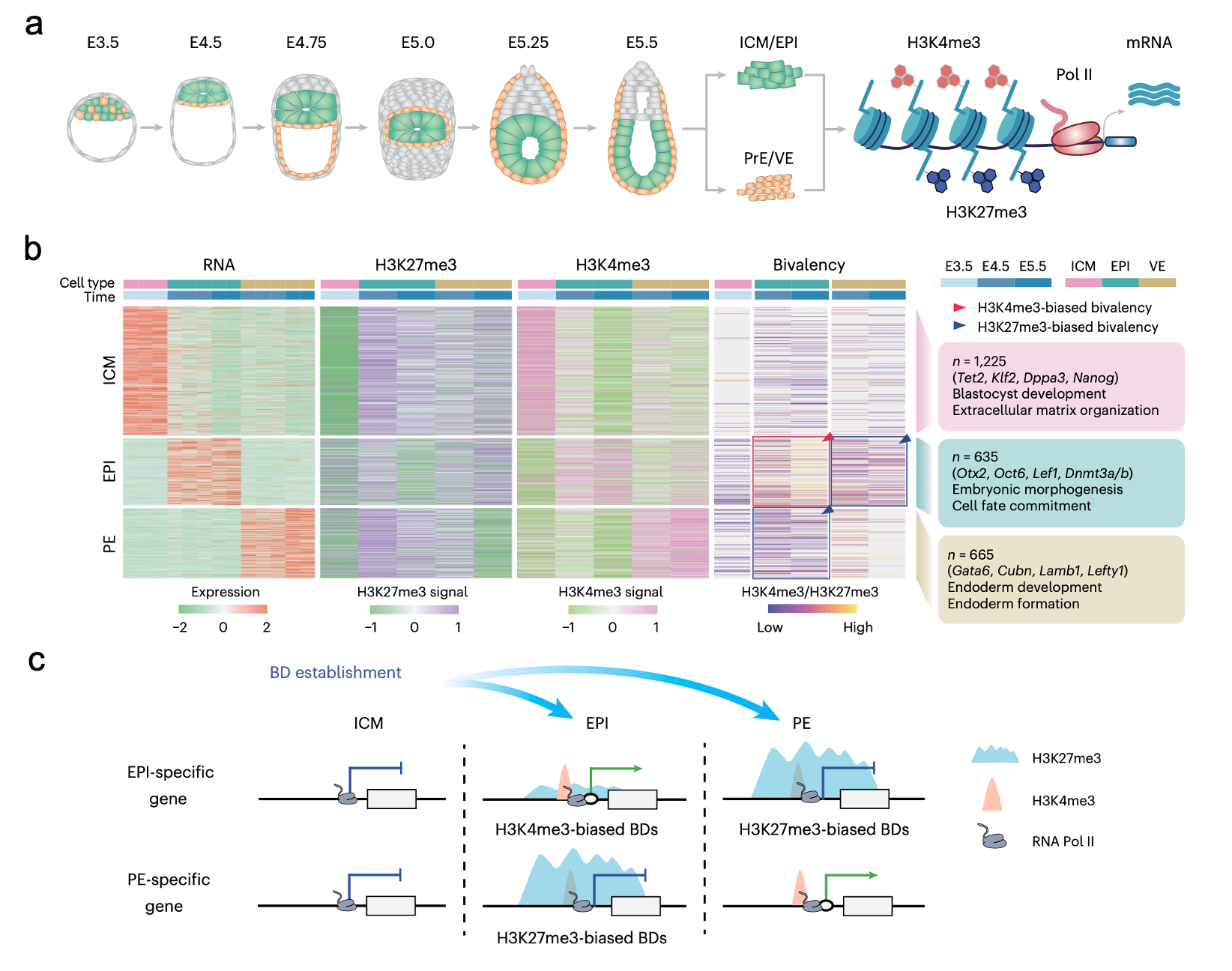
图 1. 围着床期胚层命运抉择中的二价修饰动态建立模式。
在上胚层多能性退出过程中,二价修饰呈现显著动态变化。依据H3K27me3动力学特征可分为两类:“瞬时二价状态”(Transient Bivalency;TB)和“经典二价状态”(Canonical Bivalency;CB)。TB 基因的 H3K27me3 修饰短暂维持后逐渐解离,多见于多能性相关基因,其启动子在植入前即预结合 Pol II,随着发育进程推进,基因表达在植入过程被逐渐激活;CB基因则长期维持 H3K27me3 富集,多分布于发育相关基因,持续受抑制。功能实验表明,H3K27me3 的动态去除是 TB 状态正常解离的前提。抑制去甲基化酶 KDM6A/B 会导致TB基因的 H3K27me3异常滞留,阻碍多能性基因的激活和细胞命运转变。
以往研究已发现DPPA2/4、TET及BEND3 等多种因子通过防止基因沉默或抑制过早激活参与二价染色质的调控[4-6],然而,二价结构域在时空上的精确动态调控机制仍不清晰。为此,本研究通过构建结合转录/染色质调控因子结合数据与胚胎验证的筛选框架,系统鉴定出多个调控围着床期二价修饰的关键因子,包括ZBTB17、OTX2和TFAP2C。其中,ZBTB17的作用最为显著。研究人员利用dTAG降解系统构建ZBTB17-dTAG小鼠和干细胞模型,实现了对ZBTB17蛋白的时间精确降解。结果显示,ZBTB17可直接结合于TB基因启动子区,与KDM6A/B协同作用,促进H3K27me3移除,从而驱动TB状态解离并激活多能性关键基因(如 Otx2、Fgf5、Lef1等)。ZBTB17缺失会导致H3K27me3的异常滞留、多能性相关基因表达受阻,最终造成围着床期发育停滞(图 2)。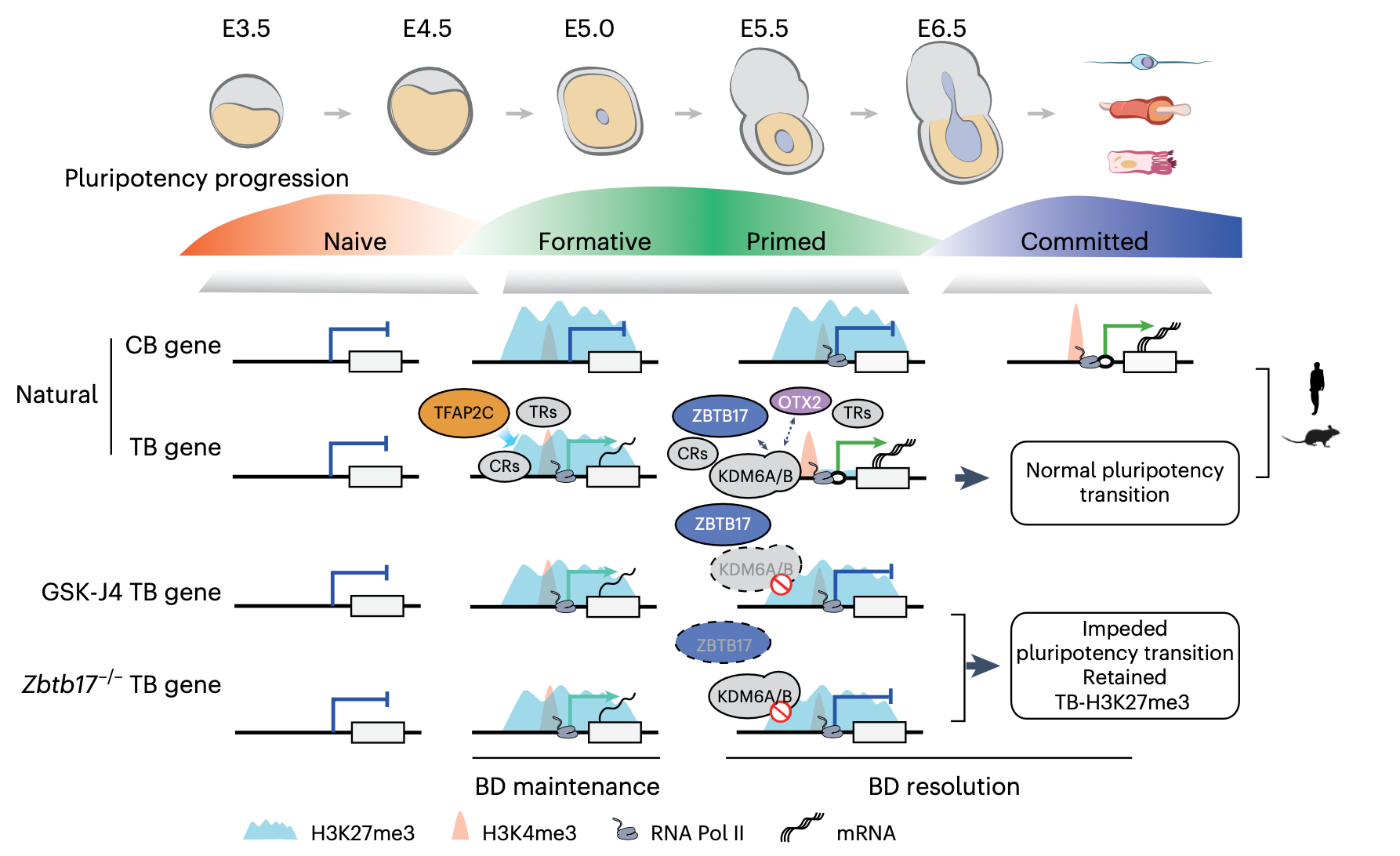 图 2. 围着床期胚胎中二价染色质状态的有序建立与时序性解离参与调控多能性退出。
图 2. 围着床期胚胎中二价染色质状态的有序建立与时序性解离参与调控多能性退出。
值得注意的是,研究还发现人类胚胎干细胞在多能性状态转变过程中也存在保守的瞬时二价状态(hTB)。在人类体系中,ZBTB17的缺失同样导致hTB基因H3K27me3滞留和多能性转换障碍,但其调控强度与作用靶基因范围存在着物种差异。
综上,本研究首次揭示了瞬时二价状态在小鼠围着床期胚胎发育中的关键作用,并发现ZBTB17与去甲基化酶 KDM6A/B 驱动TB 状态上的H3K27me3动态去除,确保多能性退出和谱系特化的时序进行。该发现不仅深化了对早期发育中表观遗传动态调控与细胞命运耦合机制的理解,也为研究多能性调控与发育障碍提供了新的理论框架。
同济大学生命科学与技术学院的副教授李延鹤、博士研究生何金灿、博士后刘营东为该论文的共同第一作者,同济大学刘文强教授、高绍荣教授、江赐忠教授为该论文的共同通讯作者。此外,同济大学章小清教授、徐从玲教授、北京航空航天大学生物与医学工程学院杜婧教授为本课题研究做出了重要贡献。
原文链接:https://www.nature.com/articles/s41556-025-01776-w
1.Bernstein, B.E., et al., A bivalent chromatin structure marks key developmental genes in embryonic stem cells. Cell, 2006. 125(2): p. 315-26.
2.Liu, X., et al., Distinct features of H3K4me3 and H3K27me3 chromatin domains in pre-implantation embryos. Nature, 2016. 537(7621): p. 558-562.
3.Xiang, Y., et al., Epigenomic analysis of gastrulation identifies a unique chromatin state for primed pluripotency. Nature Genetics, 2019. 52(1): p. 95-105.
4.Eckersley-Maslin, M.A., et al., Epigenetic priming by Dppa2 and 4 in pluripotency facilitates multi-lineage commitment. Nature Structural & Molecular Biology, 2020. 27(8): p. 696-705.
5.Zhang, J., et al., Highly enriched BEND3 prevents the premature activation of bivalent genes during differentiation. Science, 2022. 375(6584): p. 1053-1058.
6.Macrae, T.A., J. Fothergill-Robinson, and M. Ramalho-Santos, Regulation, functions and transmission of bivalent chromatin during mammalian development. Nat Rev Mol Cell Biol, 2023. 24(1): p. 6-26.
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


