Chemical Engineering Journal|汪世龙教授团队开发新型Sr-LDH纳米颗粒并揭示其通过调节骨质疏松骨微环境逆转疾病的机制
随着全球老龄化进程加速,骨质疏松及其引发的脆性骨折已成为社会重大医疗负担(仅欧美国家年治疗费用即超过5万亿美元)。该疾病以骨吸收超过骨形成为特征,常伴随慢性炎症反应。这种炎症会持续激活M1型巨噬细胞极化,增强破骨细胞生成与活性、抑制成骨细胞分化能力,形成恶性循环。当前临床药物存在功能单一性局限:促骨药物(如雌激素、双膦酸盐)或抗骨吸收药物(如氟化物、甲状旁腺激素)均未能兼顾骨质疏松微环境整体调节,因此开发兼具多效性的新型药物至关重要。
2025年9月23日,汪世龙教授课题组在线发表题为“Strontium-doped Layered Double Hydroxides with Nitrate as Interlayer Anion Reverse Osteoporotic Microenvironment via Triple Actions of Pro-osteogenic, Anti-osteoclastic and Anti-inflammatory in Osteoporosis Therapy”的研究论文。该工作开发了Sr-LDH纳米颗粒,通过促骨生成、抗骨吸收及抗炎作用来调节骨质疏松微环境,有效缓解骨质疏松病情进程。

本项研究通过离子置换和共沉淀法成功合成了Sr-LDH纳米颗粒,经体内、外研究证实Sr-LDH能通过促骨生成、抗骨吸收和抗炎三重作用逆转骨质疏松微环境。研究进一步探讨了Sr-LDH纳米颗粒调节骨质疏松成骨微环境的分子机制。(1)在成骨分化方面,Sr-LDH能同时激活PTGER3受体和LGR5受体调控PI3K/AKT和Wnt/β-catenin信号通路,并且层间NO3-能通过FZD3受体激活Wnt/β-catenin信号通路促进成骨。(2)在破骨分化方面,Sr-LDH抑制NF-κB信号和钙信号、层间NO3-抑制MAPK (ERK/JNK)信号抑制破骨分化。(3)在抗炎方面,层间NO3-通过NF-κB信号抑制炎症。在动物体内,Sr-LDH中添加的Sr元素和层间NO3-协同增强了在预防骨质流失和恢复骨量方面的治疗效果。本研究系统阐明了Sr-LDHs及其层间阴离子通过多靶点调控微环境的作用机制,为优化骨质疏松治疗策略提供了新方向(图1)。
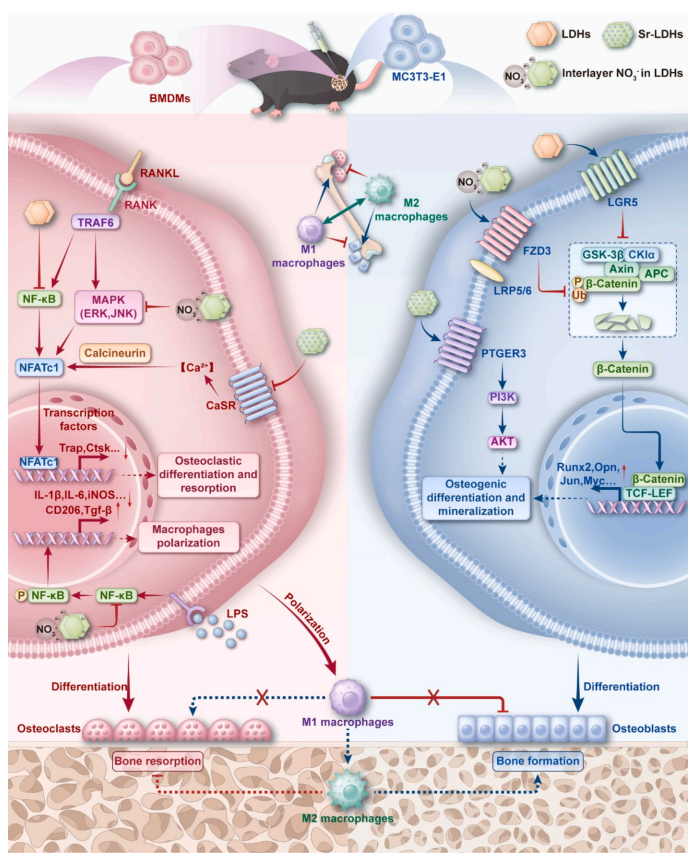
图1Sr-LDH多靶点调控骨质疏松微环境的作用机制。
同济大学生命科学与技术学院和东方医院医学科学与技术创新中心汪世龙教授,上海市宝山区中西医结合医院李莉主任和同济大学生命科学与技术学院助理教授静国欣为本文的共同通讯作者。同济大学生命科学与技术学院博士研究生魏帮国为论文第一作者,课题组博士后王虹等人也参与了该工作。本课题得到了国家自然科学基金、上海市科学技术委员会和中华国际医学交流基金会的项目资助。
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


