Cell Reports | 同济大学郭旭东/康九红教授团队揭示Zbtb16在异质化心血管前体细胞亚群命运可塑性调控中的重要作用
哺乳动物心脏是由多种心血管谱系组成的异质化器官,其发育过程依赖于复杂且精准的心血管前体细胞(Cardiovascular Progenitor,CP)命运决定调控。CP具有显著的异质性,异质化CP亚群在心血管多谱系命运转变过程中呈现差异化的分化轨迹,提示其具有高度的命运可塑性,而这一特性对于心脏结构的正确形成和功能的实现具有关键意义。然而,目前对异质化CP亚群命运可塑性的核心调控网络仍缺乏系统认识。深入解析调控异质化CP亚群命运可塑性的关键因子及其作用机制,对于构建完整的心血管谱系发育图谱,确保心脏中多谱系细胞的精准形成与分化平衡至关重要。
2025年8月7日,同济大学生命科学与技术学院郭旭东教授和康九红教授课题组在《Cell Reports》杂志上在线发表了题为“Zbtb16 determines the fate plasticity of cardiovascular progenitors through IGF2BP3-mediated mRNA stabilization”的研究,首次揭示了多能干细胞来源的三种异质化CP亚群之间的分化命运轨迹,并鉴定锌指结构蛋白Zbtb16是异质化CP亚群分化命运转变的关键调控因子。

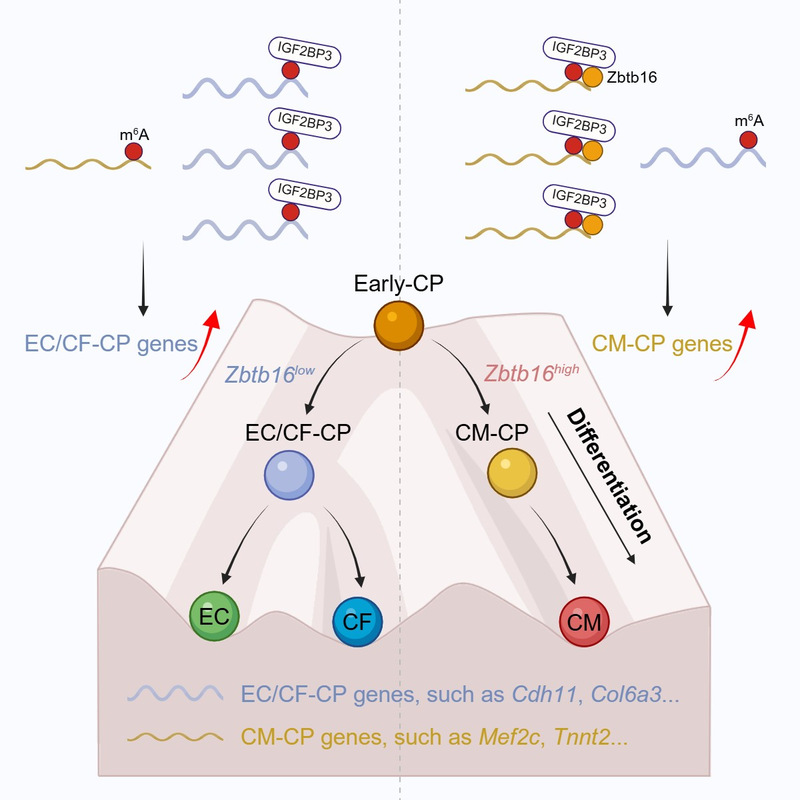
该研究利用单细胞转录组测序技术揭示了异质化CP的命运可塑性,呈现出从早期CP(Early-CP)向内皮细胞/心脏成纤维细胞命运相关CP(EC/CF-CP)或心肌细胞命运相关CP(CM-CP)亚群的分化轨迹及其转录特征的动态变化。其中,锌指结构蛋白Zbtb16是CP亚群分化命运转变的关键表观遗传调控因子。Zbtb16缺失导致显著的分化失衡,使得Early-CP更倾向于分化为EC/CF-CP,而非CM-CP。体内CP特异性敲降Zbtb16同样会引发心血管多谱系命运决定异常,导致小鼠出现心室致密化不全及心功能下降。机制研究进一步发现,胞质定位的Zbtb16能够结合并调控m6A阅读蛋白IGF2BP3的靶向特异性。Zbtb16选择性结合CM-CP亚群关键转录本(如Mef2c和Tnnt2),通过促进IGF2BP3富集于这些m6A修饰靶标上,增强其稳定性,从而维持mRNA的表达水平,推动Early-CP向CM-CP亚群的命运决定。其中,Mef2c是介导Zbtb16/IGF2BP3复合物调控Early-CP向CM-CP亚群命运决定的关键下游分子。
综上,该研究揭示了Zbtb16在CP亚群命运可塑性调控中的关键作用,为CP亚群可塑性与心血管多谱系命运决定之间的内在联系提供了新的见解。此外,发现Zbtb16与IGF2BP3之间存在重要的互作关系,显著影响IGF2BP3对mRNA的结合特异性,并调控mRNA稳定性。因此,本研究揭示了锌指结构蛋白介导特异性基因转录后调控的表观遗传新机制,深化了对m6A阅读蛋白IGF2BP3介导的mRNA稳定性调控机制的理解,为维持异质化CP分化稳态及精准调控心血管多谱系的命运决定提供了新的理论依据。
同济大学生命科学与技术学院2019级博士研究生王铻鋋为本研究的第一作者。同济大学生命科学与技术学院郭旭东教授和康九红教授为本文共同通讯作者。本研究获得国家重点研发计划、国家自然科学基金、上海市自然科学基金、中央高校基本科研业务费专项资金等项目的资助。
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


