Science Bulletin | 同济大学王译萱/高绍荣教授团队揭示人着床前囊胚三胚层谱系间的细胞通讯互作网络及其对滋养外胚层命运决定的重要作用
人类早期胚胎发育依赖于细胞间复杂的信号传导网络,其在胚层命运决定与维持中发挥着至关重要的作用。由于人类天然胚胎样本的稀缺性与伦理争议,系统解析胚层间通讯互作网络一直面临挑战。
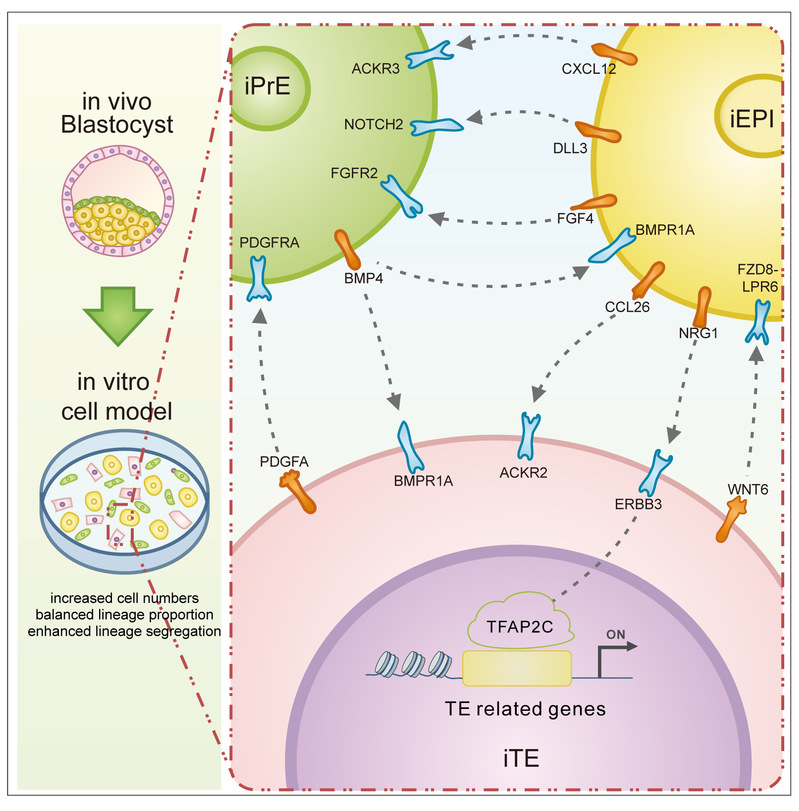
近日,同济大学王译萱教授和高绍荣院士课题组在Science Bulletin上发表了题为“Intercellular crosstalk within human preimplantation lineages regulates trophectoderm specification”的研究论文。该研究构建了一个可模拟人植入前EPI(外胚层)、PrE(原始内胚层)与TE(滋养层)三胚层的体外模型,成功揭示了胚层间细胞通讯互作图谱,鉴定了调控TE细胞命运决定的关键信号通路并进一步解析了其作用机制。
研究团队前期通过系统分析人类胚胎干细胞从primed态向naive态(primed-to-naïve)诱导过程中的单细胞转录组数据,绘制了高分辨率的细胞命运转变图谱,发现在诱导第8天会同时出现分别具有人植入前EPI、TE和PrE三胚层谱系特征的中间细胞亚群 (iEPI、iTE、iPrE)。进一步借助CellChat细胞互作分析工具,研究团队系统绘制了人囊胚期三胚层间的复杂细胞通讯互作网络,涵盖多种分泌型、细胞-细胞接触型及细胞外基质互作类信号通路。
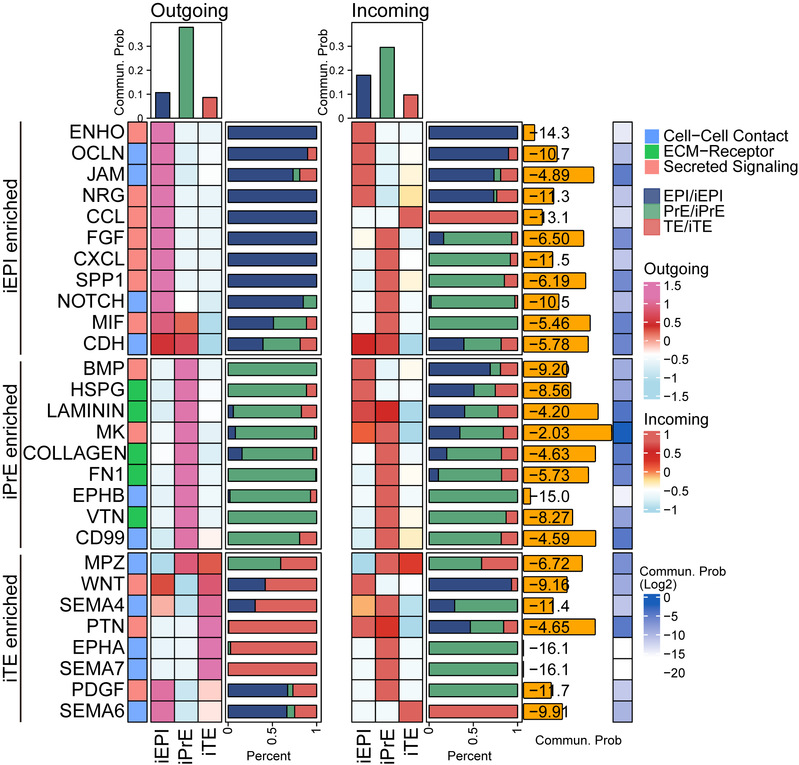
研究发现分泌性NRG信号通路显著富集于“EPI→TE”通讯网络,EPI谱系通过分泌NRG1与TE细胞表面的ERBB3受体互作。通过体外滋养层细胞诱导实验,该研究发现并证实了NRG1-ERBB3互作信号对TE谱系细胞命运决定的重要作用,并进一步在类囊胚形成和天然胚胎发育实验中得到了充分验证:敲除或抑制ERBB3受体都显著抑制囊胚腔的形成与TE标志基因的表达,进而阻碍胚胎发育进程。
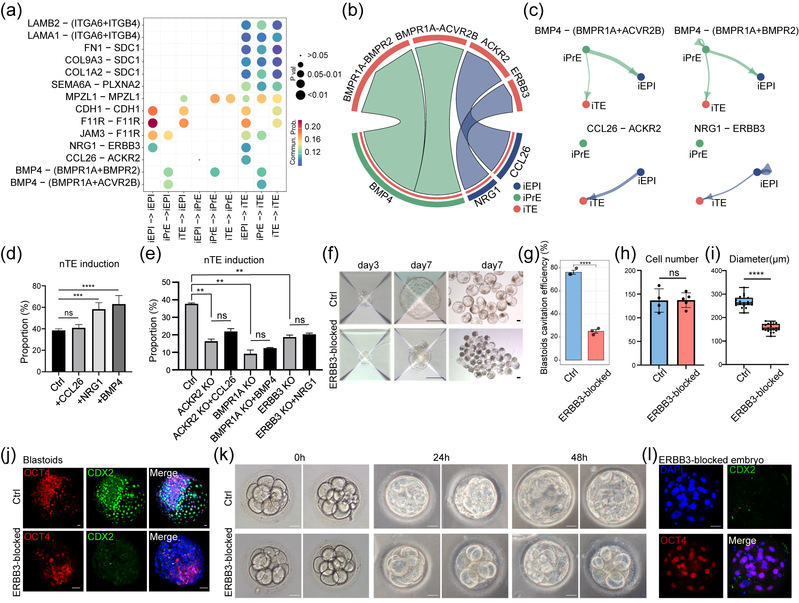
此外,该研究还结合基因共表达网络分析,确立了TFAP2C在NRG1-ERBB3通路中作为下游效应因子的核心作用,揭示NRG1-ERBB3通路通过调控TFAP2C介导TE命运的实现。本研究系统揭示了人囊胚期三谱系间的细胞通讯互作图谱,并鉴定出NRG1-ERBB3-TFAP2C信号轴作为EPI调控TE谱系命运的重要机制之一。这一发现不仅深化了人类胚胎发育早期命运决定机制的理解,也为构建更完善的人囊胚体外模型与相关疾病的研究奠定了理论基础。
同济大学涂志奋博士、毕焱副教授和博士研究生林覃为该论文的共同第一作者。同济大学王译萱教授、高绍荣院士、毕焱副教授为该论文的共同通讯作者,本研究获得了科技部重点研发计划、国家自然科学基金、上海市曙光计划、晨光计划与中国博士后科学基金的支持。
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


