Clinical and Translational Medicine| 徐艳萍课题组揭示去泛素化酶OTUD5调控胃癌铁死亡的机制
胃癌作为消化系统常见的恶性肿瘤之一,其高发病率和死亡率严重威胁着全球人类的健康。尽管靶向治疗取得了一定进展,但耐药问题使得深入探究胃癌病理机制、开发新治疗策略迫在眉睫。铁死亡作为一种铁依赖性的细胞死亡方式,在肿瘤发展中扮演着重要角色,而谷胱甘肽过氧化物酶4(GPX4)是铁死亡的关键负调控因子,在胃癌中高表达,促进肿瘤生长。因此,靶向调控GPX4诱导胃癌细胞发生铁死亡成为一种潜在的治疗策略。
近日,同济大学生命科学与技术学院/附属同济医院徐艳萍团队在Clinical and Translational Medicine发表题为p53 inhibits OTUD5 transcription to promote GPX4 degradation and induce ferroptosis in gastric cancer的研究成果,该研究发现卵巢肿瘤结构域蛋白5(OTUD5)通过去泛素化铁死亡关键蛋白谷胱甘肽过氧化物酶4(GPX4)调控其蛋白稳定性,抑癌基因p53通过转录抑制OTUD5调控铁死亡。胃癌中p53突变或缺失导致OTUD5表达上调,进而稳定GPX4蛋白水平,抑制铁死亡,促进胃癌的进展。

在该项工作中,研究团队通过一系列实验发现卵巢肿瘤结构域蛋白5(OTUD5)能与GPX4相互作用,通过去泛素化GPX4调控其蛋白水平,敲低或敲除OTUD5促使GPX4更不稳定,使胃癌细胞对铁死亡更敏感。进一步研究发现,p53作为重要的肿瘤抑制因子,其激活剂 nutlin-3a可以抑制OTUD5的转录,导致GPX4降解,进而诱导胃癌细胞发生铁死亡。鉴于多种癌症中存在p53突变或缺失,研究人员对设置了p53野生型、突变型和缺失实验组,发现只有野生型p53具有抑制OTUD5转录的能力,而p53突变或缺失则增加OTUD5的表达,促进胃癌的进展。
在体内实验中,利用CRISPR-Cas9技术在胃癌细胞中敲除OTUD5显著抑制了肿瘤的生长。临床病理样本的免疫组化分析也证实,OTUD5和GPX4 的表达水平与胃癌的进展呈正相关,而p53的活性则与胃癌进展呈负相关。
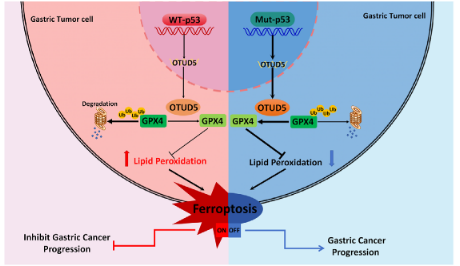
综上所述,该研究首次阐明了p53失活通过转录上调OTUD5,去泛素化并稳定GPX4,从而抑制铁死亡并促进胃癌进展的分子机制。这一发现揭示了OTUD5可作为胃癌治疗的新靶点,为开发针对p53失活型胃癌的靶向治疗药物提供了理论基础。
同济大学生命科学与技术学院的硕士研究生张君静、博士研究生田通关和同济大学附属同济医院的李新星主任为本文的共同一作。同济大学生命科学与技术学院/附属同济医院徐艳萍教授为通讯作者。该研究获得国家重点研发计划、国家自然科学基金项目、上海市科委和中央高校基本科研业务费的资助。
徐艳萍课题组长期招聘博士后,也欢迎感兴趣的硕士博士研究生报考。如有兴趣,可发送个人简历至yanpingxu@tongji.edu.cn
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


