SCIENCE CHINA Life Sciences | 高绍荣/江赐忠/鞠振宇/乐融融/陈陟阳研究团队揭示三维基因组在衰老造血干细胞炎症应答中的作用机制
造血干细胞(Hemapoietic stem cells,HSCs)能够长期自我更新并且分化成各类成熟血细胞,对于维持血液系统稳态至关重要[1,2]。造血干细胞的功能会随着年龄增长逐渐衰退,包括造血干细胞分化平衡的打破、移植后自我更新能力和造血重建能力下降等[3,4]。阐明造血干细胞衰老的分子机制对于改善其细胞功能以及相关血液疾病的治疗具有重要意义。
炎症是造血干细胞衰老的重要驱动力,引发了造血干细胞的髓系分化偏移和淋系分化能力减弱[5]。染色质三维结构对细胞命运决定起重要调控作用,研究团队前期发现,抑制染色质构架蛋白复合物cohesin的核心组分Rad21可拮抗急性炎症对造血干细胞中NF-κB信号通路的激活,同时降低急性炎症对衰老造血干细胞的功能损耗[6]。提示染色质三维结构重塑可能参与了造血干细胞炎症应答,但其具体作用机制还有待进一步研究。
2024年12月27日,同济大学生命科学与技术学院的高绍荣/乐融融研究团队,江赐忠研究团队与暨南大学鞠振宇/陈陟阳的研究团队在SCIENCE CHINA Life Sciences上发表题为“Altered 3D Genome Reorganization Mediates Precocious Myeloid Differentiation of Aged Hematopoietic Stem Cells in Inflammation” 的研究论文,该研究发现了年轻和衰老造血干细胞在急性炎症早期就表现出显著不同的应答反应,并解析了其背后的分子机制。
研究人员采用了脂多糖(Lipopolysaccharides,LPS)注射来诱导小鼠急性炎症发生,并比较了年轻和衰老小鼠的造血干细胞的急性炎症应答反应。研究发现炎症刺激破坏了衰老造血干细胞分化和自我更新之间的平衡,加速了衰老造血干细胞的分化,进而导致衰老造血干细胞自身数量减少。相反的,年轻造血干细胞在应对炎症刺激时会维持自我更新和分化的平衡。
研究人员进一步探究调控造血干细胞炎症应答的分子机制,分析并比较了年轻和衰老小鼠的造血干细胞在炎症刺激前后的转录组、三维基因组和染色质构架蛋白CTCF的基因组结合位点的特征。发现炎症刺激引起的差异表达基因(Differential expressed genes,DEGs)在年轻和衰老造血干细胞中存在显著差异,并与年轻和衰老造血干细胞差异性的炎症应答反应相关。年轻造血干细胞主要上调了DNA损伤修复和细胞周期相关通路的基因,而衰老的造血干细胞的上调基因富集在髓系分化和炎症反应相关的通路。
研究人员发现,炎症刺激会引起NF-κB信号通路基因在年轻的造血干细胞中被瞬时激活,而在衰老的造血干细胞中持续高表达。NF-κB信号通路调控的下游靶基因在衰老造血干细胞中相对年轻造血干细胞表现出更高及更为持续的激活模式,这些在衰老造血干细胞中特异激活的基因与髓系分化和炎症相关。此外,NF-κB在衰老造血干细胞中特异激活了多个转录因子如Junb、Maf的表达。研究人员发现JUNB的结合基序在衰老造血干细胞持续高表达基因的启动子上高度富集,提示NF-κB可能通过激活JUNB调控衰老造血干细胞特异的炎症应答基因的表达。进一步的分析发现,NF-κB抑制剂处理可显著缓解急性炎症所引起的衰老造血干细胞的分化和耗竭。
接下来,研究人员分析了炎症刺激下造血干细胞三维基因组的变化特征,并重点分析了与基因的转录调控密切相关的染色质环结构的变化。发现在炎症刺激下年轻的造血干细胞特异形成的染色质环中富集了细胞周期和DNA损伤修复相关的基因,而衰老造血干细胞特异形成的染色质环中则富集了髓系基因。研究人员进一步分析了染色质构架蛋白CTCF在这个过程中的作用。发现在炎症刺激下,造血干细胞中的CTCF的基因组结合位点发生了显著的动态变化。研究人员在年轻和衰老造血干细胞中鉴定到了大量的CTCF差异性结合位点,并且这些差异结合位点上同时也存在NF-κB的结合基序,表明NF-κB和CTCF可能通过协同作用调控了造血干细胞应对炎症刺激的三维基因组重塑和转录组的动态变化。进一步的分析发现,衰老造血干细胞在炎症刺激后,调控髓系分化的重要转录因子Batf2[7]的增强子和启动子区域的染色质开放性和CTCF结合强度相对年轻造血干细胞显著增加,并伴随Batf2在衰老造血干细胞中的特异性激活。
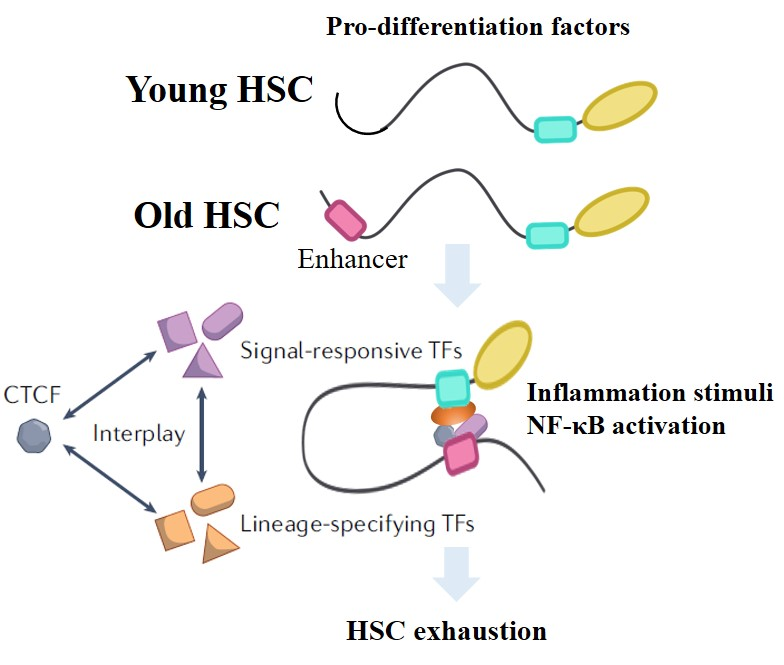
综上所述,本研究发现年轻和衰老造血干细胞在急性炎症早期就表现出显著不同的应答反应,并解析了年轻和衰老造血干细胞在炎症应答早期的转录组和三维基因组结构的变化特征,揭示了NF-κB和三维基因组介导的基因表达调控在造血干细胞炎症应答中的重要作用。为进一步揭示造血干细胞的衰老机制提供了重要的理论依据。
同济大学博士生崔昕宇、董钰,暨南大学博士生詹蔷为本文的并列第一作者。同济大学高绍荣教授,江赐忠教授,乐融融教授,暨南大学鞠振宇研究员,陈陟阳研究员为本文的共同通讯作者。
1 Cheng, H., Z.F. Zheng, and T. Cheng, New paradigms on hematopoietic stem cell differentiation. Protein & Cell, 2020. 11(1): p. 34-44.
2 Yuan, S., et al., Understanding the SMART features of hematopoietic stem cells and beyond. Sci China Life Sci, 2021. 64(12): p. 2030-2044.3 Colom Díaz, P.A., J.J. Mistry, and J.J. Trowbridge, Hematopoietic stem cell aging and leukemia transformation. Blood, 2023. 142(6): p. 533-542.
4 Rossi, D.J., et al., Cell intrinsic alterations underlie hematopoietic stem cell aging. Proc Natl Acad Sci U S A, 2005. 102(26): p. 9194-9199.5 Bogeska, R., et al., Inflammatory exposure drives long-lived impairment of hematopoietic stem cell self-renewal activity and accelerated aging. Cell Stem Cell, 2022. 29(8): p. 1273-1284.
6 Chen, Z., et al., Cohesin-mediated NF-κB signaling limits hematopoietic stem cell self-renewal in aging and inflammation. J Exp Med, 2019. 216(1): p. 152-175.
7 Hormaechea-Agulla, D., et al., Chronic infection drives Dnmt3a-loss-of-function clonal hematopoiesis via IFNγ signaling. Cell Stem Cell, 2021. 28(8): p. 1428-1442.e6.
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


