Nat Commun | 尹晓磊团队建立新型人小肠类器官研究平台
成体干细胞来源的类器官是一种重要的体外研究工具,能够高度模拟体内组织的发育、稳态维持和再生过程。凭借其接近体内真实环境的细胞组成、组织结构及功能特征,类器官已成为研究发育机制、疾病发生发展以及药物筛选的重要平台。
自2011年首次建立人小肠类器官培养体系以来,这一技术平台在过去十余年中不断发展完善1。尽管研究人员在2018年和2022年相继开发了改良的培养条件,目前的人小肠类器官(human small intestinal organoid, hSIO)仍难以完整模拟体内小肠组织的特征2,3。现有体系面临两个主要问题:一是前体细胞比例过高,难以自发产生潘氏细胞(Paneth cell, PC)等功能性细胞;二是难以同时实现干细胞自我更新和多向分化,往往在增殖能力和细胞多样性之间难以平衡:要么偏向维持干细胞状态而牺牲细胞多样性,要么需要额外的分化步骤而影响增殖能力。这些问题严重限制了人小肠组织的体外模拟及其在疾病机理研究中的应用。如何在体外同时实现干细胞的自我更新和多向分化,获得同时具有增殖能力和细胞多样性的类器官,一直是该领域亟待解决的重要挑战。
为解决这一问题,同济大学尹晓磊团队创新性地提出了以退为进(regress to progress)的策略,即通过增强类器官中干细胞的干性和可塑性,提升其分化潜能,从而实现细胞多样性。研究团队运用基因编辑技术,构建了LGR5-mNeonGreen人小肠干细胞实时荧光报告系统,用于精确追踪类器官体系中干细胞的动态变化。结合小分子药物筛选,团队成功建立了新型人小肠类器官体系,并在此基础上通过微环境信号调控,重现了人小肠细胞命运的动态调控过程。这一策略不仅突破了传统培养方法中干细胞自我更新与分化难以平衡的限制,也为其他类型的类器官研究提供了新思路。相关研究成果以A tunable human intestinal organoid system achieves controlled balance between self-renewal and differentiation为题发表于Nature Communications4。

该团队开发的新型人小肠类器官体系(TpC体系)展现出更强的增殖能力和更高的LGR5+干细胞比例,同时具有更丰富的分化细胞类型,尤其是含有更多的潘氏细胞和成熟的小肠上皮细胞(enterocyte)。与传统培养方法相比,该团队开发的TpC体系突破了现有技术瓶颈,具有多项突出优势:首先,该体系实现了一步法培养,无需复杂的分步骤分化过程,既可保持类器官的快速增殖能力,又能自发分化产生多种细胞类型;其次,培养条件简单且具有良好的均一性,显著提高了类器官培养的效率和可重复性,为高通量药物筛选等应用提供了可能。更重要的是,新型体系更真实地模拟了体内肠道组织的细胞组成和功能特征,特别是成功实现了潘氏细胞的自发产生,这在之前的培养体系中难以实现。利用小分子药物筛选和基因编辑技术,团队进一步揭示了HDAC抑制剂在提高干细胞比例、促进潘氏细胞分化的作用机制。这一新型类器官体系的建立为肠道疾病的机理研究、药物开发以及个性化治疗方案的制定提供了重要的研究平台。
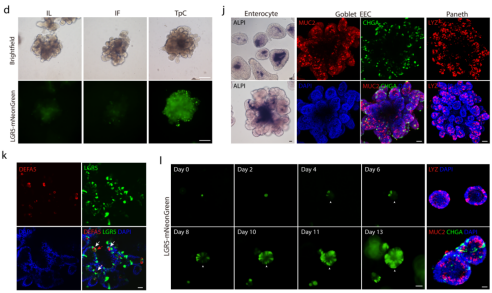
图1 TpC体系下的新型人小肠类器官
此外,研究团队通过调控Wnt、Notch、BMP等信号通路,首次系统解析了人小肠上皮细胞命运调控网络,成功实现了向四种主要功能细胞类型的定向分化。研究发现,人源和小鼠来源的肠道上皮细胞在命运调控机制上具有相似性,这一发现为后续相关研究奠定了重要基础5。这一研究成果对于深入理解肠道发育与相关疾病,以及开发基于干细胞的治疗方法具有重要意义。
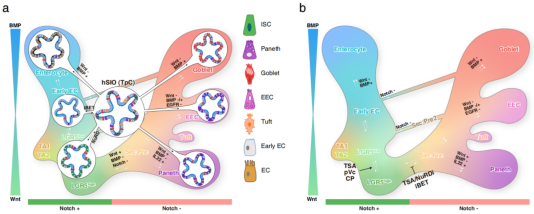
图2 人小肠干细胞命运动态平衡模型
同济大学生命科学与技术学院及附属东方医院尹晓磊教授为本文的通讯作者,同济大学博士后杨莉、博士研究生汪旭磊为本文的共同第一作者,博士研究生周星宇,硕士研究生陈泓宇、邓鲤凌,同济大学附属东方医院宋森涛,科研助理姚珧参与了本项研究工作。本研究得到了同济大学生命科学与技术学院、教育部细胞干性与命运编辑前沿科学中心、同济大学附属东方医院的大力支持,受到了国家科技部,自然科学基金委,上海市科委等项目的资助。团队已对这一新型培养方法申请了专利,后续将展开相关转化工作。
1. Sato, T. et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology 141, 1762–1772 (2011).
2. He, G.-W. et al. Optimized human intestinal organoid model reveals interleukin-22-dependency of paneth cell formation. Cell Stem Cell 29, 1333-1345.e6 (2022).
3. Fujii, M. et al. Human Intestinal Organoids Maintain Self-Renewal Capacity and Cellular Diversity in Niche-Inspired Culture Condition. Cell Stem Cell 23, 787-793.e6 (2018).
4. Yang, L. et al. A tunable human intestinal organoid system achieves controlled balance between self-renewal and differentiation. Nat. Commun. 16, 315 (2025).
5. Yin, X. et al. Niche-independent high-purity cultures of Lgr5 + intestinal stem cells and their progeny. Nat. Methods 11, 106–112 (2014).
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


