Nature Communications | 张赫团队揭示长非编码RNA与编码基因协同调控肿瘤发生新机制
肿瘤细胞具有高度异质性,在同一或不同基因座上,常常存在异常长非编码RNA(Long noncoding RNAs, lncRNAs)和异常编码基因协同调控肿瘤发生的现象。这些异常lncRNA和编码基因受到从一维至三维层面上遗传和表观遗传因素的复杂转录调控,然而,这种多层次调控的精确协同机制仍不完全清楚。因此,探索这些来自同一或不同基因座的lncRNA和编码基因如何协同调控恶性肿瘤发生发展,具有重要科学意义和潜在临床价值。

2024年9月27日,生命科学与技术学院张赫团队在《自然·通讯》(Nature Communications)上发表了题为“Prohibitin 2 orchestrates transcription of long noncoding RNA and coding gene to accelerate tumorigenesis”的最新研究成果,发现Prohibitin 2(PHB2)作为穿梭因子,调控了CANT2 lncRNA和编码基因CCBE1的异常协同转录,加速恶性黑色素瘤的发生发展,阐明了肿瘤表观遗传调控新模式。
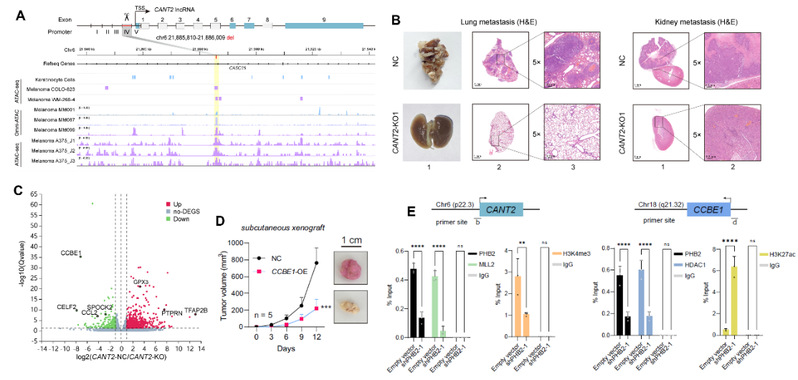
该研究发现,在黑色素瘤细胞中,chr6p22.3位点处于开放染色质状态,为PHB2结合到新发现的CANT2 lncRNA启动子创造了合适条件。PHB2随后招募组蛋白甲基转移酶MLL2结合到CANT2启动子,增加H3K4三甲基化水平,激活致癌lncRNA CANT2的转录激活,显著促进了肿瘤生长和转移。有意思的是,PHB2进一步与激活的CANT2转录本结合,定位到抑癌基因CCBE1的启动子区域。在此过程中,PHB2招募组蛋白去乙酰化酶HDAC1,降低CCBE1启动子区域的H3K27乙酰化水平,抑制CCBE1转录。当敲降PHB2后,PHB2与lncRNA CANT2和编码基因CCBE1启动子的结合水平显著下降,两种组蛋白修饰因子结合均同步下降,显著降低组蛋白修饰水平,使CANT2和CCBE1的转录水平同时改变,表明PHB2是新发现的具有协同调控lncRNA-基因转录的关键穿梭因子,为肿瘤潜在治疗提供了新的靶点选择。
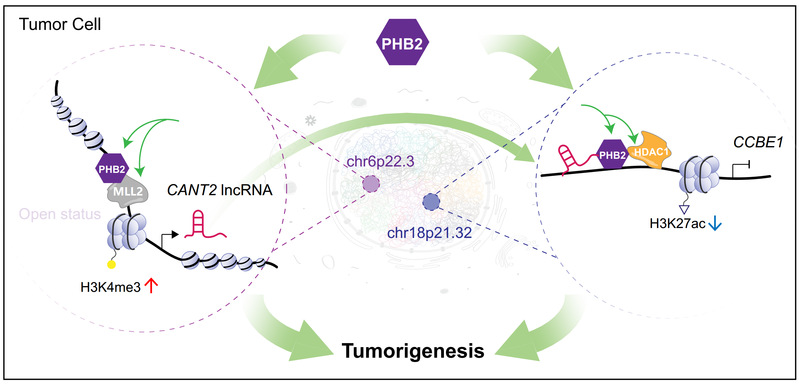
综上所述,该研究揭示了穿梭因子PHB2协同调控lncRNA和编码基因的新机制,为肿瘤发病机理提供了有趣的“一石二鸟”模型,同时PHB2这一特性也为未来发现更多类似疾病调控穿梭因子,并针对这类穿梭因子设计靶向药物提供了新路径。
作为同济大学对口支援井冈山大学的联合学术成果,这是井冈山大学历史上首次以共同通讯单位在Nature系列子刊发表研究论文。同济大学丁天宜博士、博士研究生徐浩文和张晓宇博士是该文的共同第一作者,同济大学张赫教授为该文唯一通讯作者。同时,该工作还获得了同济大学生命科学与技术学院、同济大学附属东方医院、器官发育与表观遗传江西省重点实验室、井冈山大学附属医院临床医学研究中心、井冈山大学医学部和生命科学学院的大力支持,受到了国家重点研发计划、国家自然科学基金委和上海市科委等项目的资助。
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


