Advanced Science | 李维达/张振宁团队利用干细胞神经分化和脑类器官研究肥胖和抑郁恶性循环的发病机制
肥胖和抑郁症是全球人群所面临的两大主要的健康挑战。肥胖人群中抑郁患者的高发病率和抑郁人群中肥胖患者的高发病率都预示着肥胖和抑郁的共病表征对人体健康的危害性更大,肥胖和抑郁的共病也逐渐引起人们的关注。由于一直缺乏合适的人类疾病模型,因此发病机制尚未阐明,意味着研究和解决肥胖和抑郁共病的难题迫在眉睫。
近日,同济大学附属东方医院再生医学研究所、心脏病学国家重点实验室及医学创新中心、同济大学生命科学与技术学院、教育部“细胞干性与命运编辑”前沿科学中心李维达/张振宁团队在Advanced Science杂志发表题为“The WFS1-ZnT3-Zn2+ axis regulates the vicious cycle of obesity and depression”的文章,该研究发现,神经系统特异性敲除WFS1通过扰乱体内锌离子稳态加剧了高脂饮食诱导的肥胖和抑郁,而靶向神经系统的药物Riluzole不仅可以减缓高脂饮食导致的抑郁,还可以通过调节进食来减缓肥胖。该研究证实肥胖与抑郁的互卷关系,并在三维人脑类器官和二维神经前体细胞系统内阐述了WFS1基因在这段恶性循环中的作用机制,发现Riluzole有望成为治疗肥胖和抑郁共病的潜在治疗药物。

研究人员通过分析澳大利亚男性肥胖和抑郁症的患病率,发现肥胖者患抑郁症的风险是普通人群的1.48倍,同时抑郁症患者肥胖的风险是普通人群的1.4倍。该研究结果预示了抑郁症和肥胖的恶性循环会导致抑郁和肥胖的同时发生,从而加重了患病的风险。先前的研究结果表明,WFS1基因突变(rs1046322)与东南亚人群的BMI和腰围显著相关。研究人员以WFS1为靶点,利用神经系统特异性敲除Wfs1小鼠通过高脂饮食构建肥胖模型。研究发现,通过6个月的高脂饮食肥胖模型构建成功,神经系统特异性敲除Wfs1小鼠体重明显高于普通小鼠,表明Wfs1缺失增加了小鼠对高脂诱导肥胖的易感性。该研究进一步发现,在持续高脂饮食下,不仅野生型小鼠出现了抑郁样行为,神经系统特异性敲除Wfs1小鼠的抑郁样行为明显比普通小鼠更加严重。因此整体来说,Wfs1缺失加重了高脂饮食诱导的肥胖和抑郁样行为。
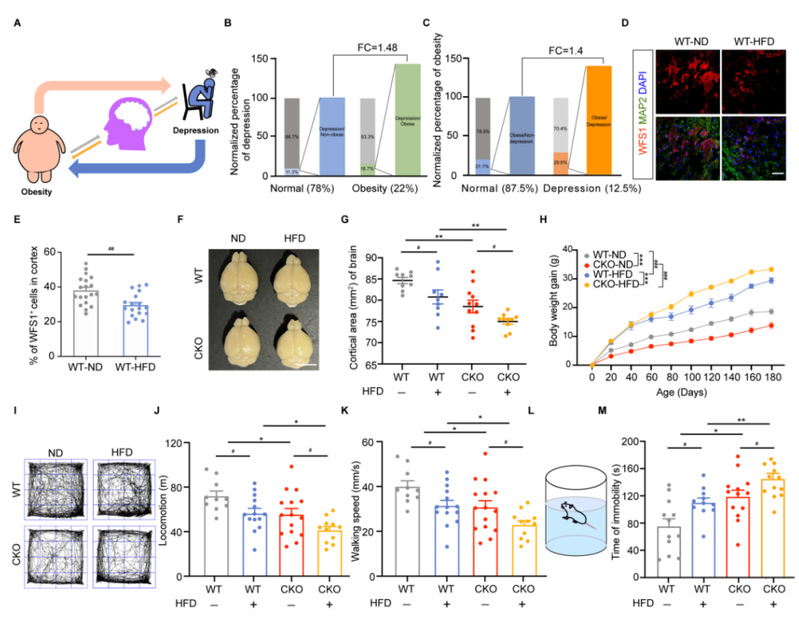
为阐述WFS1基因在肥胖和抑郁恶性循环的作用机制,研究人员利用CRISPR/Cas9技术生成WFS1敲除的人类胚胎干细胞,并诱导分化为三维人脑类器官和二维神经前体细胞,揭示了WFS1-ATF4-ZnT3信号轴参与棕榈酸通过扰乱锌离子稳态诱导细胞凋亡的作用机制,而Riluzole靶向该信号轴逆转锌离子稳态失衡诱导的细胞凋亡。
针对上述发病机制,研究人员进一步探究Riluzole对高脂食物诱导肥胖和抑郁的治疗效果。通过Riluzole治疗肥胖小鼠2个月后,高脂饮食的野生型小鼠和神经系统特异性敲除Wfs1小鼠的抑郁样行为均得以改善。另一方面,两组小鼠均出现对高脂食物的食欲显著下降、基础代谢增加、体重显著降低的现象,表明Riluzole不仅减轻了高脂饮食诱导的肥胖和抑郁样行为,也降低了Wfs1缺失对高脂饮食诱导的代谢综合征的易感性,为治疗肥胖和抑郁的恶性循环提供了新思路、新方法。
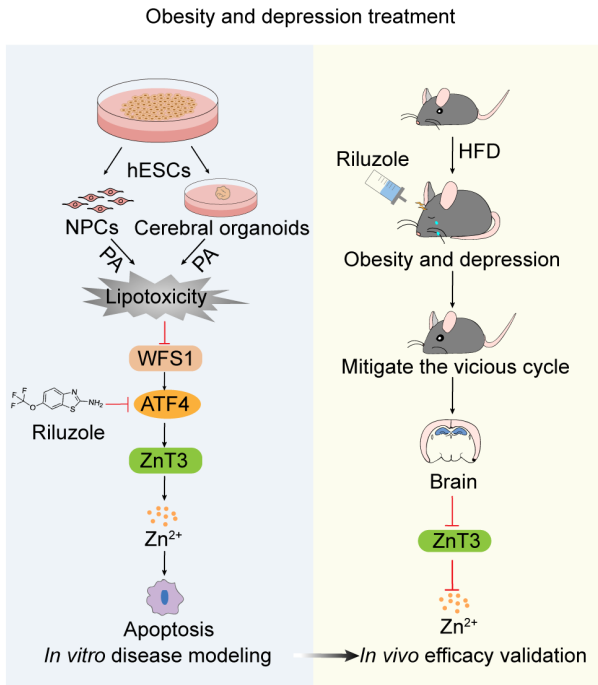
综上,该研究以WFS1为靶点,揭示了Riluzole 在缓解肥胖和抑郁恶性循环的作用机制,为治疗肥胖和抑郁共病提供了新思路、新方法。
同济大学附属东方医院再生医学研究所、心脏病学国家重点实验室及医学创新中心、同济大学生命科学与技术学院、教育部“细胞干性与命运编辑”前沿科学中心李维达教授,同济大学生命科学与技术学院张振宁长聘副教授为本文共同通讯作者。同济大学博士生巩梦婷,同济大学硕士生方语林为本文共同第一作者。
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


