汪世龙教授课题组在《Biomaterials》发表论文揭示纳米层状双氢氧化物作为功能性载体降低化疗药物引发的胚胎毒性的分子机制
2019年11月25日,汪世龙教授课题组在《Biomaterials》杂志上在线发表题为“Layered double hydroxide eliminate embryotoxicity of chemotherapeutic drug through BMP-SMAD signaling pathway”的研究论文。该研究通过小鼠胚胎干细胞(mESCs)和ICR孕鼠作为体内外模型研究纳米材料LDH-VP16在胚胎发育中的作用,结果表明纳米搭载的方式能抑制药物引起的mESCs细胞凋亡、自我更新和分化特性的缺失,挽回mESCs的细胞功能及干细胞特性,首次阐释了纳米材料作为载体对药物引发的胚胎毒性的保护效果。
胚胎发育过程容易受到各种因素影响,孕期暴露于化疗药物对胎儿的毒性往往不可逆转,因此药物的临床应用需要进行胚胎安全性评价,mESCs由于其无限增殖及多向分化的潜能广泛应用于药物的胚胎毒性研究。本研究采用mESCs作为体外胚胎发育评价模型,发现纳米层状双氢氧化物(LDH)的搭载显著降低化疗药物依托泊苷(VP16)引起的mESCs细胞毒性,包括对细胞存活率、克隆形成能力、细胞凋亡、细胞周期及线粒体膜电位的影响,并能够在很大程度上恢复mESCs的自我更新特性及向三胚层分化的能力,维持mESCs的干细胞特性。通过建立ICR早期孕鼠模型评价单独药物VP16和纳米载药体系LDH-VP16的胚胎毒性,发现在孕鼠中注射VP16引发胚胎发育滞缓、胎盘结构及标志基因表达缺失、出生后子代鼠的自主行为能力异常等现象,而通过LDH的搭载后能够有效降低药物对胚胎的毒性。利用转录组测序及加权基因共表达网络分析(WGCNA)进行机制的验证,发现发育相关的BMP-SMAD信号通路在LDH-VP16的体内外胚胎保护中起着关键作用,通过添加BMP4因子及信号通路抑制剂能够实现细胞水平的正反向功能验证。
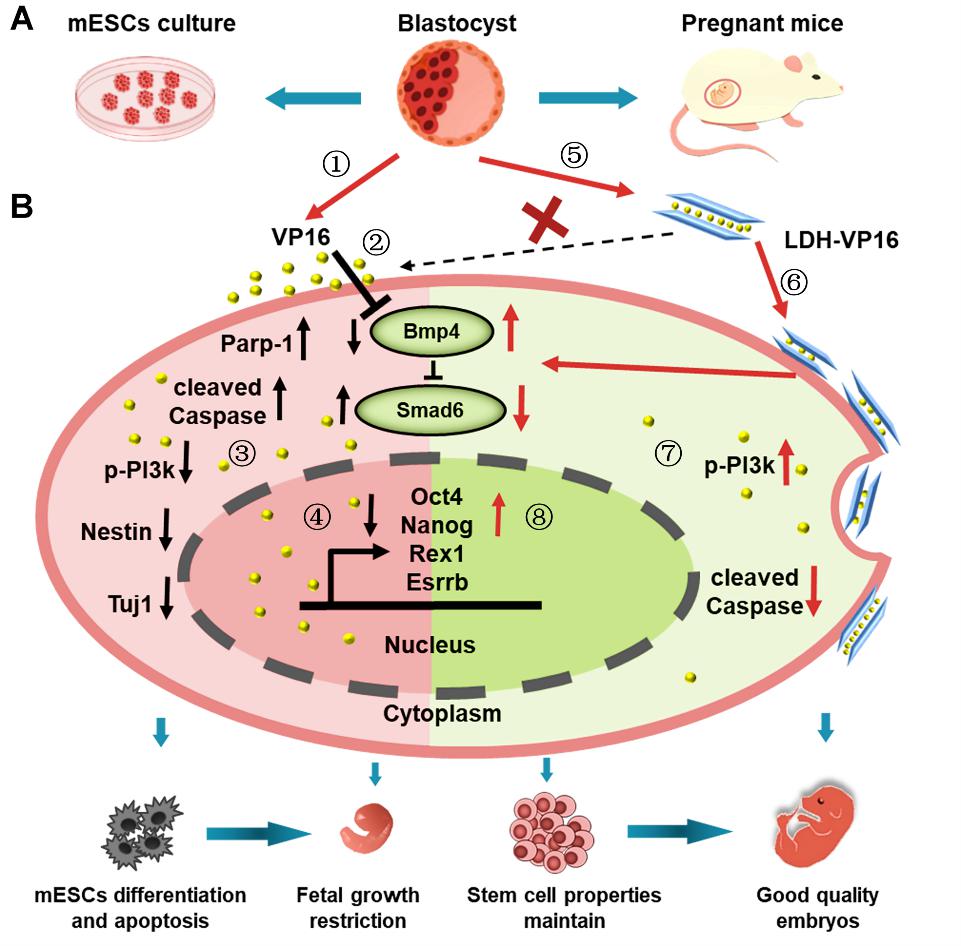
图1. 纳米层状双氢氧化物作为功能性载体降低VP16的胚胎毒性的分子机制示意图
同济大学生命科学与技术学院和东方医院转化医学研究中心汪世龙教授和朱融融教授以及上海市宝山区中西医结合医院钱叶长教授为本文的共同通讯作者。博士后王照洁为本文的第一作者。本课题得到国家自然科学基金委、国家重点研发项目和中央高校基础研究基金等项目的资助。
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


