Alzheimer’s & Dementia|侯羽君团队合作发现Urolithin A提高阿尔茨海默病的认知,恢复线粒体自噬和溶酶体功能
阿尔茨海默病(AD)是一种起病隐匿的进行性发展的神经退行性疾病,以渐进性记忆障碍、认知功能障碍、人格改变以及语言障碍等神经精神症状为主要特征。AD的病理、生理机制复杂,发病机制目前仍不清楚,其病理特征是Aβ形成的淀粉样斑块和tau蛋白形成的神经纤维缠结。然而临床上尚无可治愈或延缓AD疾病进程的药物。自噬受损,包括线粒体自噬和溶酶体功能受损,在AD中起关键作用。Urolithin A (UA)是存在于石榴以及其他一些水果和坚果中的化合物鞣花单宁的一种天然代谢产物,可诱导线粒体自噬。然而UA长期治疗AD的效果和作用机制尚不清楚。
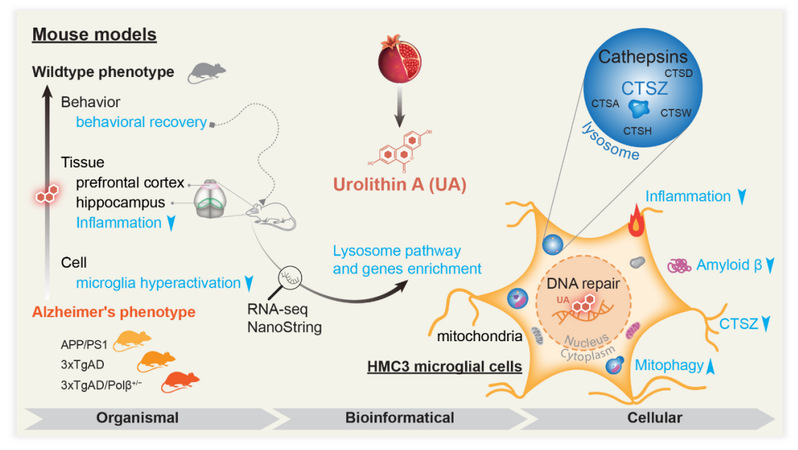
2024年5月16日,同济大学生命科学与技术学院侯羽君教授团队和美国国立卫生研究研究院的Vilhelm Bohr教授团队在国际阿尔茨海默病协会官方杂志《阿尔茨海默病与痴呆》(Alzheimer’s & Dementia)上在线发表了题为“Urolithin A improves Alzheimer's disease cognition and restores mitophagy and lysosomal functions”的最新研究成果。该研究报道了长期的UA治疗可改善AD小鼠的学习、记忆和嗅觉功能,调节其免疫反应,减少AD小鼠脑中的Aβ淀粉样蛋白和tau病理。揭示了UA通过调节组织蛋白酶Z(CTSZ)恢复溶酶体功能的分子机制,表明UA具有极大的临床转化潜力。

研究人员用行为学、电生理、生化和生物信息学的方法在三种AD小鼠模型(APP/PS1,3xTgAD和3xTgAD/Polβ+/-小鼠)中研究了UA长期给药对AD的治疗效果及机制。结果显示长期UA治疗显著改善了不同AD小鼠的学习、记忆和嗅觉功能。UA还减少了AD小鼠大脑中的淀粉样蛋白和tau病理。此外,电生理实验表明UA显著提高了AD小鼠海马区的长时程增强。研究还进一步揭示了UA通过增加溶酶体功能诱导线粒体自噬的机制,阐明了UA可以使溶酶体组织蛋白酶(主要是组织蛋白酶Z)正常化,以恢复AD溶酶体功能,表明组织蛋白酶在UA诱导的AD治疗效果中起关键作用。UA还可以改善其他AD风险因素,包括神经炎症和DNA损伤。
综上,在这项研究中,侯羽君教授及合作团队的研究强调了线粒体自噬和溶酶体功能障碍在AD发病机制中的重要性,并指出UA具有很高的临床转化潜力。
同济大学侯羽君教授为该文唯一第一作者和共同通讯作者,美国国立卫生研究院Vilhelm Bohr教授为共同通讯作者。该工作还受到了国家自然科学基金委、临港实验室和上海市科委等项目的资助。该研究还得到了Vilhelm Bohr教授实验室其他成员和挪威奥斯陆大学Evandro Fang等专家学者的合作支持。
近年来,侯羽君教授及合作团队关于线粒体自噬、NAD+和AD的系列研究成果发表在Nature Neuroscience、PNAS(2021、2018)等权威期刊,总被引次数超过4900次,这一系列研究表明了线粒体自噬作为AD治疗靶点的重要价值,也将为AD治疗提供潜在的治疗新药和新的希望。
附:招聘信息
侯羽君博士是同济大学生命科学与技术学院与上海市东方医院双聘教授。课题组近来的工作围绕线粒体自噬、神经炎症和细胞衰老,致力于研究其在衰老与阿尔茨海默病中的作用机制。诚邀各领域的优秀人才加入与合作,岗位包括博士研究生、博士后,研究方向包括但不限于神经生物学、细胞生物学、生物信息学;期待青年才俊加入!实验室信息请参见:
https://life.tongji.edu.cn/e4/61/c12618a189537/page.htm
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


