Cell death discovery|张赫团队建立诱导双靶点再平衡新方法显著提高肿瘤靶向治疗效果
恶性肿瘤是一种多基因疾病,常涉及多个癌基因的激活和抑癌基因的失活。传统的单靶点治疗主要针对一个信号通路,但肿瘤细胞常通过激活替代通路获得耐药性。因此,靶向多种肿瘤缺陷逐渐成为一种有效的治疗策略。NF-κB p65(Nuclear factor-κB p65)的过度激活和cGAS(Cyclic GMP-AMP Synthase)的异常沉默在肿瘤细胞信号传导中起重要作用,对肿瘤的发生、发展及免疫应答有着至关重要的影响。在肿瘤中,cGAS失活和NF-κB p65过度激活常常同时出现。因此,同时靶向异常失活的cGAS和过度激活的NF-κB p65是一种有潜力的抗肿瘤治疗策略。

2024年5月23日,同济大学生命科学与技术学院张赫团队在Nature集团旗下刊物《细胞死亡与发现》(Cell death discovery)发表了题为“Induced dual-target rebalance simultaneously enhances efficient therapeutical efficacy in tumors”的最新研究成果,首次建立了一种基于溶瘤腺病毒和反义寡核苷酸的“诱导双靶点再平衡”肿瘤靶向治疗新方法,该方法同时矫正了肿瘤中异常失活的cGAS和过度激活的NF-κB p65,显著提高对恶性肿瘤杀伤效果,该方法已经申请了专利保护。
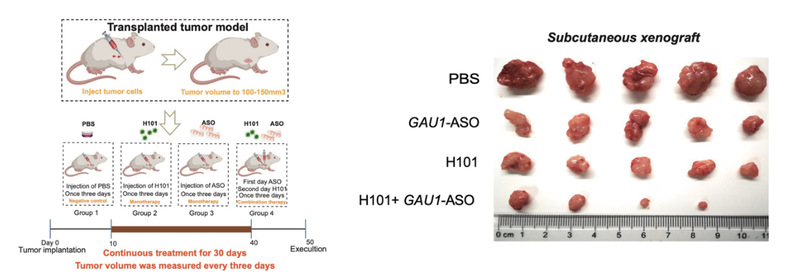
该研究以同时具有cGAS异常失活和NF-κB p65过度激活的结直肠癌作为研究对象,研究发现,一方面,溶瘤腺病毒H101感染肿瘤细胞后,能重新激活肿瘤细胞中异常沉默的cGAS,另一方面,利用反义寡核苷酸特异沉默GAU1 lncRNA能抑制肿瘤中NF-κB p65过度激活。在此基础上,使用溶瘤腺病毒H101和GAU1反义寡核苷酸联合处理肿瘤细胞,与单独处理相比,肿瘤细胞增殖速率下降了62–77%。在小鼠移植瘤模型中,联合处理组的肿瘤生长抑制率达到了88%,肿瘤重量减少了86%,取得十分显著的肿瘤杀伤效果。此外,在联合抗肿瘤杀伤药理机制上,研究发现溶瘤腺病毒H101能通过促进cGAS启动子上的H3K4三甲基化来重新激活cGAS,GAU1反义寡核苷酸则通过降低NF-κB p65启动子上H3K27乙酰化抑制NF-κB p65过度激活。
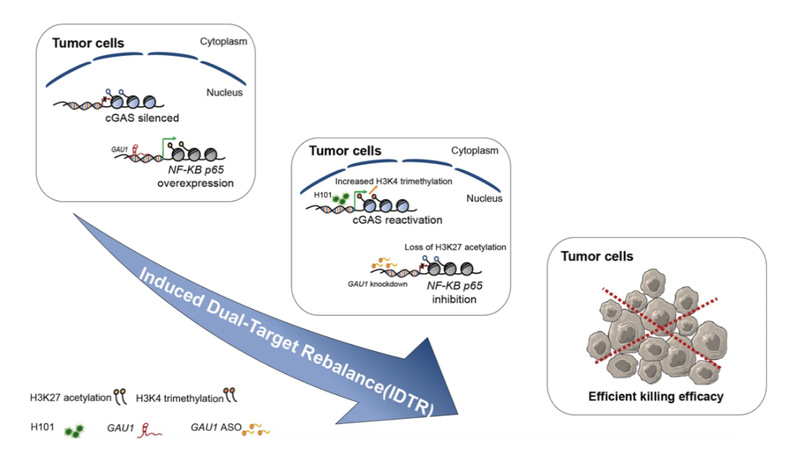
综上所述,该研究建立的“诱导双靶点再平衡”肿瘤靶向治疗新方法,为恶性肿瘤多靶点靶向治疗策略提供了新的选择,也为提高其他恶性疾病的联合治疗效果提供了新的启示。
同济大学张晓宇博士、丁天宜博士为该研究共同第一作者,同济大学张赫教授为该研究唯一通讯作者。同时,作为同济大学对口支援井冈山大学的联合学术成果,该工作获得了同济大学生命科学与技术学院、同济大学附属东方医院、江西省器官发育与表观遗传重点实验室、井冈山大学附属医院临床医学研究中心、井冈山大学医学部和生命科学学院的大力支持,该工作还受到了国家重点研发计划、国家自然科学基金委和上海市科委等项目的资助。
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


