我院康九红教授课题组与中科大施蕴瑜院士课题组合作发表《Nature Communications》文章
2019年 9月19日,我院康九红教授课题组与中国科技大学施蕴瑜院士课题组合作在《Nature Communications》杂志在线发表题为“TRIM66 reads unmodified H3R2K4 and H3K56ac to respond to DNA damage in embryonic stem cells”的研究论文,这项研究首次揭示了TRIM66蛋白在胚胎干细胞(ESC)DNA损伤修复和基因组稳定性维持中的重要作用,并建立了重要的组蛋白修饰识别蛋白与DNA损伤修复调控过程之间的密切联系。
在细胞和生物个体中,维持基因组稳定性对于保护遗传物质的完整性以及准确遗传是至关重要的,但是诸如DNA复制、转录、细胞代谢以及环境毒素等所引起的内在和外在刺激都有可能导致基因组DNA的持续损伤和断裂,从而造成生物体的过早衰老、细胞凋亡或肿瘤发生等。ESC是一类能够自我更新并发育成所有细胞类型的全能性细胞,在基础研究和临床应用中具有重大价值。与体细胞相比,ESC具有更强的自我更新和新陈代谢过程,这使其面临着更高强度的DNA损伤威胁。但是,ESC基因组依然表现出极低的突变率,这表明在ESC中存在着独有的、高效的DNA损伤修复机制,因此致力于研究ESC中特有的调控分子及其作用机制,对于理解ESC中DNA损伤修复和基因组稳定性维持的分子机理十分重要。
TRIM66蛋白是TRIM蛋白家族第C-VI亚类中的一员,其C端具有PHD-Bromo串联结构域。通过结构分析表明,TRIM66蛋白PHD结构域能够特异性识别未修饰的H3R2-H3K4,而Bromo结构域中的ZA和BC loops能够和H3K56ac相互作用。TRIM66蛋白在ESC中高表达,且在分化过程中明显下调。在ESC中对Trim66基因进行敲除或者敲降,都能够引起显著的DNA损伤和基因组不稳定现象发生,而且Trim66基因缺失的小鼠囊胚内细胞团中同样呈现较高的DNA损伤水平和基因组不稳定情况。深入研究发现,TRIM66蛋白能够与H3K56ac去乙酰化酶Sirt6相互结合,而TRIM66的敲除明显阻碍了Sirt6应激DNA损伤被富集到细胞染色质上以及H3K56ac在DNA损伤位点的去乙酰化过程。表型回复实验也表明,只有同时包含与Sirt6结合的区域以及识别组蛋白修饰的PHD-Bromo结构域的TRIM66片段才能够回复TRIM66缺失引起的DNA损伤水平升高、H3K56ac在损伤位点的滞留以及基因组不稳定现象。因此,该研究重点阐明了TRIM66作为一个新的“reader”蛋白,在DNA发生损伤时识别DNA损伤位点处的H3K56ac,并招募Sirt6到DNA损伤位点对H3K56ac进行去乙酰化,从而起始正常的DNA损伤修复进程。
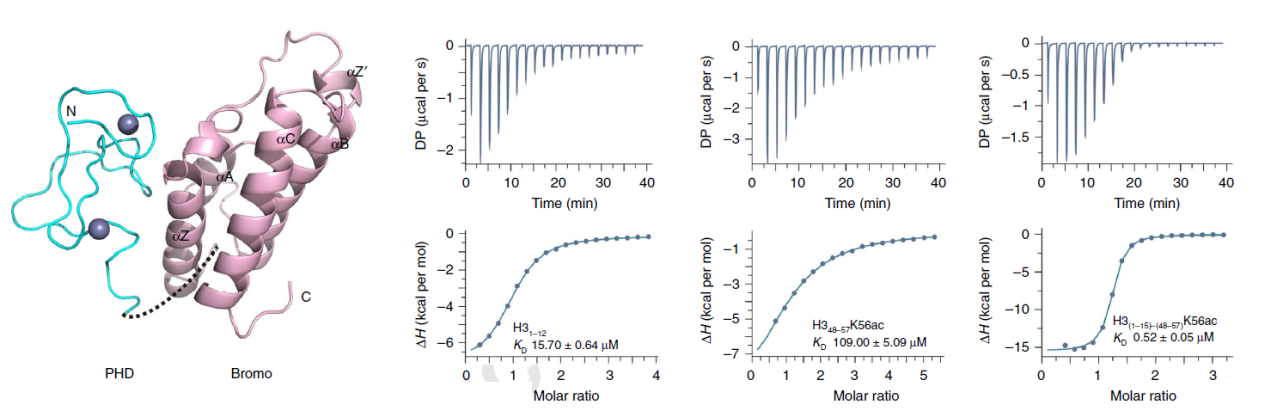
图1. TRIM66蛋白PHD-Bromo结构域识别组蛋白H3上非修饰的R2及K4以及乙酰化的H3K56修饰

图2. TRIM66蛋白调控DNA损伤修复的分子机制模式图
总之,该项研究成果首次阐明了新的“reader”蛋白TRIM66的组蛋白修饰识别模式,并明确了其调节ESC中的DNA 损伤修复和基因组完整性方面的具体分子机制,为探究ESC中DNA损伤修复的独特机制提供了新的线索和依据,并加深了我们对组蛋白翻译后修饰在DNA损伤修复和基因组稳定性维持调控中的理解。
我院康九红教授和中国科技大学施蕴渝院士为本文的共同通讯作者,中国科技大学博士生陈佳婧,我院汪子康博士和同济大学转化医学高等研究院特聘研究员郭旭东博士为本文的共同第一作者。此外,该研究中TRIM66基因敲除小鼠的研究工作得到了中国科学院北京动物所陈大华研究员及其团队的支持。本研究得到了国家科技部、国家自然科学基金委、上海市科委等项目的资助。
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


