Nucleic Acids Research|毛志勇团队揭示SIRT2在DNA损伤修复中的新功能
基因组不稳定性的增加是衰老发生及衰老相关疾病如肿瘤发生的关键特征之一,而DNA损伤修复能力的下降是导致基因组不稳定的重要原因【1,2】。生物体演化出了多条损伤修复通路以应对不同类型的DNA损伤,其中碱基切除修复 (Base excision repair,BER)与多种衰老相关疾病关系紧密【3】。
BER 通路主要修复由内源活性氧(ROS)或外源化学物质及辐射引起的碱基损伤。BER通路起始于DNA 糖基化酶去除受损的碱基或自发碱基丢失,碱基去除后所产生的碱基位点可被核酸内切酶APE1 识别并切割,形成3 ' OH 和5 '脱氧核糖磷酸(5 ' dRP)末端。随后DNA聚合酶β (Pol β)利用其裂解酶活性去除缺口处的5 ' dRP并插入缺失的碱基,由此产生的缺口由XRCC1 / DNA ligase III复合体完成连接【4】。由于碱基损伤发生概率显著高于其它类型DNA损伤,其对应的BER通路在阻止正常细胞恶性转化过程中起到了至关重要的作用。在不同类型的癌症组织细胞中观察到突变的Pol β,XRCC1多态性与亚洲患者的乳腺癌或肺癌有关【5,6】。此外,同时敲除两个糖基酶Ogg1和Myh会增加小鼠肿瘤的发生率【7】。作为长寿相关Sirtuin家族的一员,SIRT2是维持基因组稳定性的关键调节因子【8,9】。SIRT2使BARD1去乙酰化以增强BARD1- brca1的相互作用,从而促进同源重组修复【10】。此外,SIRT2通过去乙酰化CDK9和ATRIP来缓解复制应激【11,12】。尽管靶蛋白仍然未知,但SIRT2可以保护神经元免受顺铂诱导的、可由转录偶联核苷酸切除途径修复的DNA损伤【13】。最近的报道表明,SIRT2还通过多种调控机制对抗氧化应激,如FOXO3a的去乙酰化【14】。然而,SIRT2是否直接参与调控氧化应激引起的DNA碱基损伤的修复尚不清楚,其潜在的调控机制也未被阐明。
近日,同济大学生命科学与技术学院毛志勇教授团队在Nucleic Acids Research在线发表了题为SIRT2 promotes base excision repair by transcriptionally activating OGG1 in an ATM / ATR-dependent manner 的工作。该研究发现,在氧化应激反应中,ATM和ATR使SIRT2的S46和S53位点磷酸化。SIRT2的磷酸化增强了其与糖基化酶OGG1的相互作用,导致OGG1被募集到其自身的启动子上,从而提高OGG1的转录和BER效率。该团队亦发现数个与肿瘤相关的SIRT2突变体,它们对OGG1转录和BER效率的刺激作用丧失,这表明SIRT2通过促进BER来稳定基因组从而发挥其抑癌作用。

在该项工作中,研究团队利用了一种质粒损伤再激活的实验方法检测细胞内BER的效率发现SIRT2的缺失影响BER效率。并通过彗星电泳及凋亡检测实验确定氧化压力情况下缺失SIRT2会破坏细胞基因组稳定性并导致细胞凋亡。这些实验共同表明SIRT2可参与调控BER通路维持氧化压力下基因组的稳定性。进一步的机制研究表明:SIRT2 通过靶向BER通路中OGG1的转录参与BER 通路。在氧化刺激下,SIRT2与OGG1二者的相互作用增强。染色质免疫共沉淀实验显示,氧化刺激下SIRT2与OGG1均可到OGG1的启动子处,而SIRT2可进一步协助OGG1到达其自身启动子处提高OGG1自身启动子活性进而促进其自身转录。
由于SIRT2对OGG1的调控响应氧化损伤,研究团队进一步发现,在氧化刺激下,DNA损伤应答因子ATM和ATR可与SIRT2相互作用,并磷酸化SIRT2 S46和S53位点,进而增强SIRT2与OGG1的相互作用,促进OGG1的转录并提高BER效率。
为了确定SIRT2介导的OGG1转录调控的功能,研究团队使用TCGA数据库进行数据挖掘,在37个SIRT2癌症相关突变中发现有5个SIRT2突变体(R69L、F124S、P128L、R153H和G291D)无法通过提高OGG1的启动子活性及转录水平进而影响BER效率。
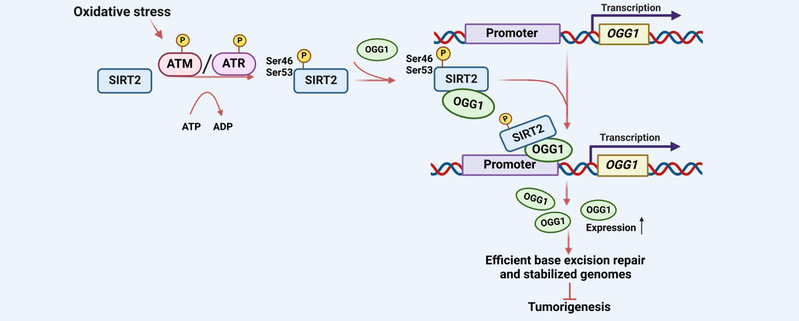
图:SIRT2通过以ATM/ATR依赖的方式激活OGG1转录促进BER模型图
综上所述,该研究团队发现了SIRT2 参与DNA 损伤修复的新功能,深入阐述了SIRT2调控OGG1自身转录的具体分子机制,以及氧化刺激下DNA损伤应答因子ATM和ATR激活SIRT2的分子机制。该研究拓宽了该领域对长寿基因SIRT2功能的整体认知,深入解析了SIRT2靶向BER通路维持基因组的稳定性最终影响肿瘤等衰老相关疾病发生的分子机制,为发展靶向SIRT2调控BER通路从而预防肿瘤等衰老相关疾病的发生的新方法奠定了理论基础。
同济大学生命科学与技术学院助理教授耿安珂博士和博士研究生孙嘉惠为本论文的共同第一作者。同济大学生命科学与技术学院毛志勇教授为本文的通讯作者。毛志勇教授课题组唐欢胤博士、于洋、汪惜月、张靖媛、王晓娜、孙小翔博士、高能、许柱博士、蒋颖副教授和中南大学湘雅医院谭嵘教授及其课题组周孝芳也参与了该项工作。
【1】Hanahan, D. (2022) Hallmarks of Cancer: New Dimensions. Cancer Discov, 12, 31-46.
【2】eggo, P.A., Pearl, L.H. and Carr, A.M. (2016) DNA repair, genome stability and cancer: a historical perspective. Nat. Rev. Cancer, 16, 35–42.
【3】Maynard, S., Schurman, S.H., Harboe, C., de Souza-Pinto, N.C. and Bohr,V.A. (2009) Base excision repair of oxidative DNA damage and association with cancer and aging. Carcinogenesis, 30, 2–10.
【4】Beard, W.A., Horton, J.K., Prasad, R. and Wilson, S.H. (2019) Eukaryotic Base Excision Repair: New Approaches Shine Light on Mechanism. Annu Rev Biochem, 88, 137-162.
【5】Starcevic, D., Dalal, S. and Sweasy, J.B. (2004) Is there a link between DNA polymerase beta and cancer? Cell Cycle, 3,998–1001.
【6】Roberts, M.R., Shields, P.G., Ambrosone, C.B., Nie, J., Marian, C., Krishnan, S.S., Goerlitz, D.S., Modali, R., Seddon, M., Lehman, T., et al. (2011) Single-nucleotide polymorphisms in DNA repair genes and association with breast cancer risk in the web study. Carcinogenesis, 32, 1223–1230.
【7】 Xie, Y., Yang, H., Cunanan, C., Okamoto, K., Shibata, D., Pan, J., Barnes, D.E., Lindahl, T., McIlhatton, M., Fishel, R., et al. (2004) Deficiencies in mouse Myh and Ogg1 result in tumor predisposition and G to T mutations in codon 12 of the K-ras oncogene in lung tumors. Cancer Res., 64, 3096–3102.
【8】 Kim, H.S. , Vassilopoulos, A. , Wang, R.H., Lahusen, T., Xiao, Z., Xu, X., Li, C., Veenstra, T.D., Li, B., Yu, H., et al. (2011) SIRT2 maintains genome integrity and suppresses tumorigenesis through regulating APC / C activity. Cancer Cell, 20, 487–499.
【9】Serrano, L., Martinez-Redondo, P., Marazuela-Duque, A., Vazquez, B.N., Dooley, S.J., Voigt, P., Beck, D.B., Kane-Goldsmith, N., Tong, Q., Rabanal, R.M., et al. (2013) The tumor suppressor SirT2 regulates cell cycle progression and genome stability by modulating the mitotic deposition of H4K20 methylation. Genes Dev., 27, 639–653.
【10】Minten, E.V. , Kapoor-Vazirani, P. , Li, C., Zhang, H., Balakrishnan, K. and Yu,D.S. (2021) SIRT2 promotes BRCA1-BARD1 heterodimerization through deacetylation. Cell Rep., 34, 108921.
【11】 Zhang, H. , Park, S.H. , Pantazides, B.G. , Karpiuk, O. , Warren, M.D. , Hardy, C.W. , Duong, D.M. , Park, S.J. , Kim, H.S. , Vassilopoulos, A. , et al. (2013) SIRT2 directs the replication stress response through CDK9 deacetylation. Proc. Natl. Acad. Sci. U.S.A., 110, 13546–13551.
【12】 Zhang, H., Head, P.E., Daddacha, W., Park, S.H., Li, X., Pan, Y., Madden, M.Z., Duong, D.M., Xie, M., Yu, B., et al. (2016) ATRIP deacetylation by SIRT2 drives ATR checkpoint activation by promoting binding to RPA-ssDNA. Cell Rep., 14, 1435–1447.
【13】Zhang, M. , Du, W., Acklin, S., Jin, S. and Xia, F. (2020) SIRT2 protects peripheral neurons from cisplatin-induced injury by enhancing nucleotide excision repair. J. Clin. Invest., 130, 2953–2965.
【14】 Wang, F., Nguyen, M., Qin, F.X. and Tong, Q. (2007) SIRT2 deacetylates FOXO3a in response to oxidative stress and caloric restriction. Aging Cell, 6, 505–514.
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


