Cell Rep | 同济大学高绍荣/高睿/陈嘉瑜/杨光研究团队揭示染色质环境在哺乳动物胚胎谱系分化中协调转录因子互作网络的分子机制
哺乳动物的合子具有全能性,通过精细而有序的谱系分化产生了生命个体复杂多样的细胞类型。第一次谱系分化形成了内细胞团(inner cell mass, ICM)和滋养外胚层(trophectoderm, TE),随后进一步发育产生胚胎和胚外两种谱系。转录因子(transcription factor, TF)在这一过程中扮演了极为重要的角色,通过结合到基因组的特定区域来调控基因的时序性表达。前期基于体外细胞模型的大量研究已证实染色质环境的重塑可以影响转录因子与基因组的结合,从而协同调控细胞的状态与命运;然而,染色质环境和转录因子如何精确协调体内胚胎的细胞分化与谱系确立尚待一步解答。
2024年4月20日,同济大学生命科学与技术学院的高绍荣/高睿/陈嘉瑜/杨光研究团队在Cell Reports上发表题为“Chromatin landscape instructs precise transcription factor regulome during embryonic lineage specification” 的研究论文,该研究揭示了以TFAP2C为中心的转录因子调控网络在围着床期胚胎不同谱系分化过程中发挥的功能,提出了染色质环境对胚胎发育中转录因子结合的可塑性调控机制。

研究人员首先对小鼠从桑椹胚(morula)时期到植入后第6.5天胚胎中TFAP2C的全基因组结合位点进行了捕获,发现TFAP2C在胚胎围着床期发育的不同谱系中呈现显著的结合动态变化,这种结合模式的转变与胚胎细胞的状态与命运密切相关。其中,CDX2作为TFAP2C的下游转录因子,协同调控胚外外胚层(extraembryonic ectoderm,ExE)谱系的发育;而在上胚层(epiblast,Epi)谱系的发育过程中,TFAP2C与NANOG、SOX2等经典的多能性转录因子,通过结合到具有“超级二价态”(super-bivalent)的启动子及附近区域,协同调控发育相关基因的转录状态。
值得注意的是,该研究阐述了H3K9me3依赖性异染色质环境在调控谱系转录因子的基因组结合和胚胎细胞命运决定中发挥的作用。在植入后的ExE谱系中,新生(de novo)的H3K9me3修饰能够抑制TFAP2C在胚胎发育相关基因上的结合,使得这些基因在后续的原肠运动过程中始终沉默表达,从而维持了胚外谱系的发育特性。
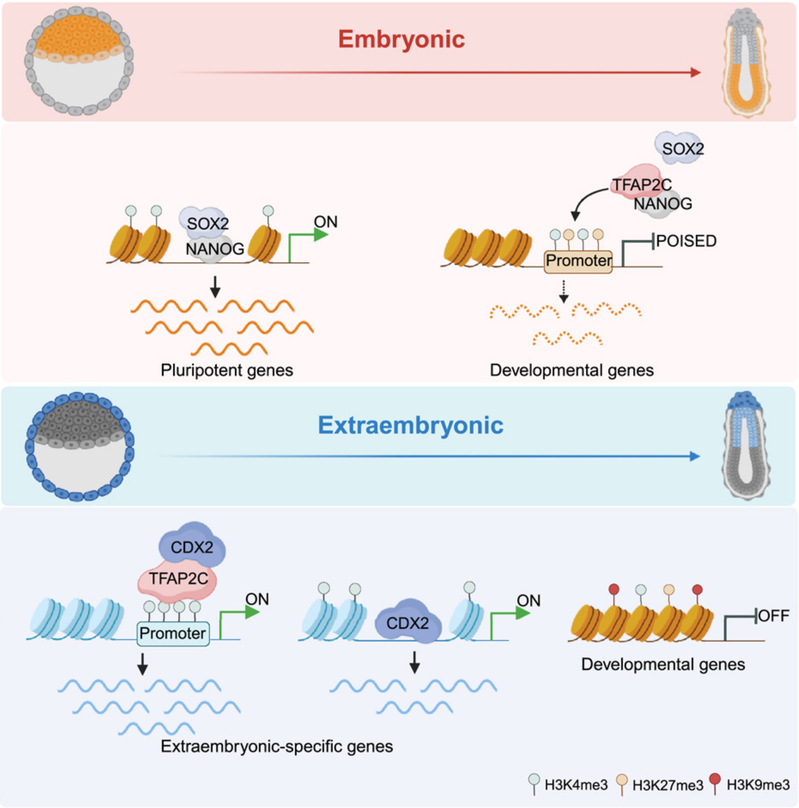
染色质环境对胚胎谱系分化中转录因子结合的可塑性调控
综上所述,这项研究工作系统揭示了以TFAP2C为中心的转录因子调控网络在围着床期胚胎不同谱系分化过程中发挥的功能,阐明了TFAP2C与经典的谱系转录因子CDX2和NANOG/SOX2之间的协同调控关系,同时展示了染色质环境如何指导非先锋转录因子的结合,进而调控这段时期胚胎细胞的基因转录和命运状态。值得一提的是,该研究不仅是对高绍荣团队近期发表的Developmental Cell工作(Dev Cell | 高绍荣/江赐忠/高睿/陈嘉瑜揭示小鼠早期胚胎发育中以TFAP2C为核心的转录因子调控网络)的延申,也为理解胚胎发育过程中的转录因子结合调控提供了新的思考角度。
同济大学高绍荣院士、高睿副教授、陈嘉瑜教授、杨光博士为本文的共同通讯作者,同济大学王莉萍博士、博士生易珊如、博士生崔昕宇为本文的共同第一作者。该研究获得科技部、基金委及上海市科委等项目的资助。
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


