Dev Cell | 高绍荣/江赐忠/高睿/陈嘉瑜揭示小鼠早期胚胎发育中以TFAP2C为核心的转录因子调控网络
哺乳动物的早期胚胎发育过程伴随细胞分化潜能的转变,具有全能性的合子在囊胚时期完成第一次细胞命运决定,形成内细胞团 (inner cell mass, ICM) 和滋养层 (trophectoderm, TE)。这一谱系分化过程受到染色质修饰和转录因子协同调控,随着微量表观组学技术的发展,已有非常多的研究揭示了表观遗传修饰在其中发挥的重要作用。相比之下,转录因子(transcription factor, TF) 的结合位点有限并且具有瞬时性,在微量胚胎样本条件下解析其对于胚胎发育的调控机制存在巨大挑战。尽管如此,得益于方法学的不断优化,TF的神秘面纱正在被逐渐揭开1,2。然而,更多潜在关键TF以及调控TF结合的分子机制尚需进一步阐明。
2024年4月3日,同济大学生命科学与技术学院高绍荣/江赐忠/高睿/陈嘉瑜研究团队在Developmental Cell杂志上发表题为“Defining a TFAP2C-centered transcription factor network during murine peri-implantation” 的研究论文,该研究揭示了小鼠早期胚胎发育阶段以转录因子TFAP2C为中心的调控网络,提出代谢、表观环境和遗传信息三级联合调控TFAP2C的结合,从而驱动胚胎发育的顺利进行。

该研究基于团队先前发表在Cell Stem Cell上的研究数据(Cell Stem Cell | 高绍荣/江赐忠/陈嘉瑜合作揭示Dux可介导修复SCNT胚胎的异常H3K9ac修饰并提高克隆效率),对体细胞核移植(somatic cell nuclear transfer, SCNT) 胚胎在桑椹胚(Morula) 时期异常低H3K9ac区域进行motif分析,发现转录因子TFAP2C显著富集3。有趣的是,同时期,Magdalena团队在Science上报道TFAP2C对于胚胎极化极为关键,但其上下游调控网络尚不清晰4。于是,研究人员通过uliCUT&RUN技术绘制了小鼠8细胞时期到第6.5天 (extraembryonic ectoderm,ExE以及epiblast ,Epi) 胚胎中TFAP2C的全基因组结合位点图谱,并使用ABC模型(activity-by-contact model) 鉴定TFAP2C介导启动子-增强子互作 (promoter-enhancer interactions)。通过对promoter端和enhancer端进行motif富集,得到了若干参与调控环路的潜在因子。其中包括了被报道起到双向激活功能的NR5A2以及参与胚胎极化的TEAD44,5。研究人员不仅验证了TEAD4为TFAP2C的下游因子,还发现KLF5同样作为TFAP2C的下游因子参与细胞极化和细胞命运决定。
接着,研究人员探究了影响TFAP2C结合的可能因素。有趣的是,研究人员发现卵母细胞来源的视黄酸(RA)可介导受精后SINEs发生主动去甲基化,从而促进TFAP2C的结合,这一结论从代谢的角度丰富了人们对转录因子结合的理解,并且和最近报道的维生素A代谢在成体干细胞的调控作用相呼应6。
值得注意的是,本研究所用胚胎的母源为C57背景,父源为PWK背景,这使得TFAP2C在父母源上的结合可被PWK父本所携带的单核苷酸多态性(Single-Nucleotide Polymorphism, SNP) 所区分。因此,通过鉴定亲本链特异性结合区域(allele-biased peaks,ABPs),研究人员发现母源继承而来的抑制性修饰H3K27me3和H3K9me3使得TFAP2C更倾向于在父源链上结合,这说明表观基因印记会影响TFAP2C的结合。然而,即使研究人员分析了所有的印记基因,也只能解释6%左右的ABPs产生,这暗示还有其他因素影响TFAP2C的结合。研究人员惊喜地发现enhancer上的相关SNP通过作用于结合序列,使得TFAP2C的结合产生偏向性,而该结论在CAST等其他远交鼠系中也得到了验证。得益于本研究平台能够无偏地比较基因组印记与SNP对于转录因子结合、靶基因表达之间的关系,研究者发现SNP相对于前者的调控方式更为广泛,并且处在不断进化中,而调控强度相对较弱,更有利于种系多样性的产生。
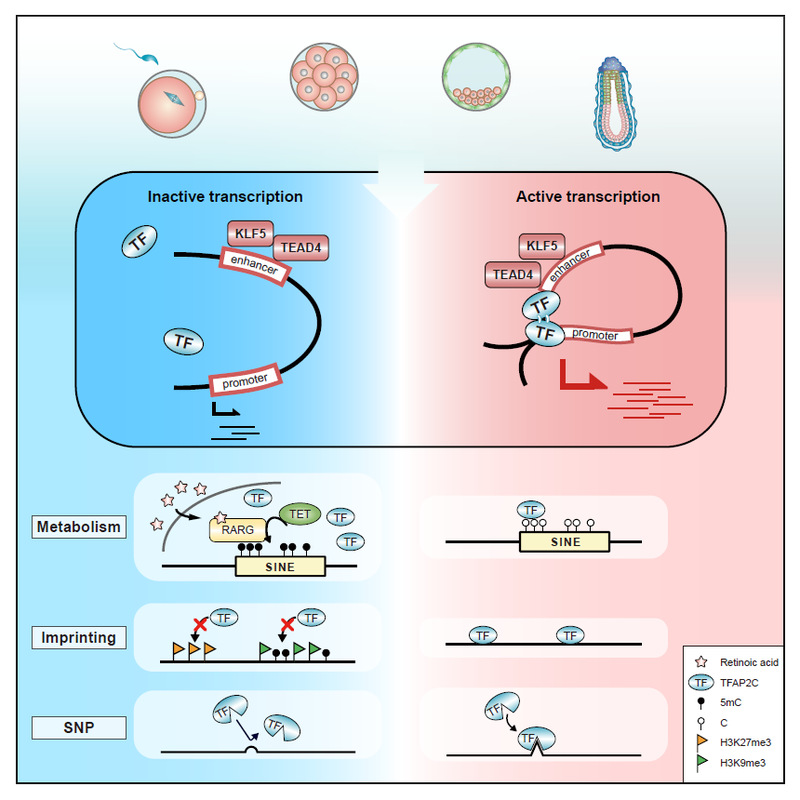
小鼠早期胚胎发育过程中以TFAP2C为核心的代谢、表观印记和遗传信息三元调控模型
综上所述,这项研究工作不仅刻画了转录因子TFAP2C的全基因组结合图谱,鉴定并验证了其下游转录因子TEAD4和KLF5, 还从代谢、表观印记和基因组突变三个不同角度证明了其对转录因子结合的影响,刻画了以TFAP2C为核心的转录因子调控网络,为转录因子结合调控提供了新的思考角度,帮助研究者更好地理解早期胚胎发育和细胞命运决定。
同济大学高绍荣院士、江赐忠教授、高睿副教授、陈嘉瑜教授为本文的共同通讯作者;同济大学副教授高睿、博士后杨光、博士生王梦婷、博士生肖菁为本文的共同第一作者。该研究获得科技部、基金委及上海市科委等项目资助。
1. Lijia Li,* Fangnong Lai,* Xiaoyu Hu,* Bofeng Liu,* Xukun Lu, Zili Lin, Ling Liu, Yunlong Xiang, Tristan Frum, Michael A. Halbisen, Fengling Chen, Qiang Fan, Amy Ralston, and Wei Xie#. Multifaceted SOX2-chromatin interaction underpins pluripotency progression in early embryos. Science 2023 Dec 15;382(6676):eadi5516 (2023).
2. Gassler J, Kobayashi W, Gáspár I, Ruangroengkulrith S, Mohanan A, Gómez Hernández L, Kravchenko P, Kümmecke M, Lalic A, Rifel N, Ashburn RJ, Zaczek M, Vallot A, Cuenca Rico L, Ladstätter S, Tachibana K. Zygotic genome activation by the totipotency pioneer factor Nr5a2. Science. 2022 Dec 23;378(6626):1305-1315. doi: 10.1126/science.abn7478. Epub 2022 Nov 24. PMID: 36423263.
3. Yang G, Zhang L, Liu W, Qiao Z, Shen S, Zhu Q, Gao R, Wang M, Wang M, Li C, Liu M, Sun J, Wang L, Liu W, Cui X, Zhao K, Zang R, Chen M, Liang Z, Wang L, Kou X, Zhao Y, Wang H, Wang Y, Gao S, Chen J, Jiang C. Dux-Mediated Corrections of Aberrant H3K9ac during 2-Cell Genome Activation Optimize Efficiency of Somatic Cell Nuclear Transfer. Cell Stem Cell. 2021 Jan 7;28(1):150-163.e5. doi: 10.1016/j.stem.2020.09.006. Epub 2020 Oct 12. PMID: 33049217.
4. Zhu M, Cornwall-Scoones J, Wang P, Handford CE, Na J, Thomson M, Zernicka-Goetz M. Developmental clock and mechanism of de novo polarization of the mouse embryo. Science. 2020 Dec 11;370(6522):eabd2703. doi: 10.1126/science.abd2703. PMID: 33303584; PMCID: PMC8210885.
5. Lijia Li,* Fangnong Lai,* Ling Liu, Xukun Lu, Xiaoyu Hu, Bofeng Liu, Zili Lin, Qiang Fan, Feng Kong, Qianhua Xu,Wei Xie#. Lineage regulators TFAP2C and NR5A2 function as bipotency activators in totipotent embryos. Nat Struct Mol Biol (2024).
6. Tierney MT, Polak L, Yang Y, Abdusselamoglu MD, Baek I, Stewart KS, Fuchs E. Vitamin A resolves lineage plasticity to orchestrate stem cell lineage choices. Science. 2024 Mar 8;383(6687):eadi7342. doi: 10.1126/science.adi7342. Epub 2024 Mar 8. PMID: 38452090.
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


