Nature Communications| 李维达教授团队及合作者首次通过基因编辑实现更成熟和更稳定的人多能干细胞到胰岛细胞的诱导分化技术
过去的10年间(2011年-2021年),我国糖尿病患者人数由9000万增加至1亿4000万,增幅高达56%。糖尿病的巨额医疗支出给患者、家庭及社会带来极为沉重的负担。糖尿病因发病机理不同主要分为1型糖尿病和2型糖尿病,但随着病程的发展患者体内胰岛β细胞数量均出现显著减少,导致胰岛素分泌绝对不足。因此,除了基本的外源胰岛素注射治疗外,寻找合适的β细胞替代疗法已成为糖尿病治疗的核心环节与根本途径。目前临床上已开展的胰岛异体移植术可有效治疗糖尿病,但无奈受限于供体缺乏,供需严重失衡;而由人胚胎干细胞诱导分化为胰岛β细胞(human embryonic stem cell derived β cell, SC-βcell ) 的技术以其数量优势为糖尿病的治疗带来了新的希望。
就人多能干细胞诱导分化为胰岛β细胞这一前沿技术而言,目前学界达成共识,认为存在两大瓶颈制约其发展:1. 功能成熟性差,不能良好地响应葡萄糖刺激;2.在糖尿病人体内高脂、高糖的代谢压力下存在脆弱性,无法长期存活。因此,如何获取功能更加成熟且能长期稳定发挥作用的胰岛β细胞是一个亟待解决的问题。长久以来,通过基因编辑改善β细胞功能和生存是目前学术界聚焦的热点,但是还没有实质性进展,其中一个重要因素是缺乏合适的靶点。
2022年7月16日,同济大学生命科学与技术学院、同济大学附属东方医院再生医学研究所、教育部“细胞干性与命运编辑”前沿科学中心李维达教授课题组与合作者们在Nature Communications杂志发表题为ZnT8 loss-of-function accelerates functional maturation of hESC-derived β cells and resists metabolic stress in diabetes的论文1,该研究以SLC30A8(功能失活降低人类患糖尿病的风险)基因为靶点,在干细胞中敲除该基因并进行β细胞诱导分化,实现了SC-β细胞功能与生存能力的强化,突破了制约该技术的两大瓶颈,推动了糖尿病的细胞替代疗法的发展。

1.ZnT8功能缺失促进SC-β细胞功能成熟
SLC30A8 基因编码的锌离子转运蛋白ZnT8是胰岛特异性的锌转运蛋白,高表达于β细胞分泌囊泡,负责将锌离子从细胞质转运进入胰岛素分泌囊泡当中。该研究发现,缺失ZnT8蛋白的SC-β细胞总是在较高浓度葡萄糖(20 mM)刺激下表现出旺盛的胰岛素分泌能力,这引起了他们的兴趣。进一步研究发现,ZnT8只表达于SC-β细胞分化发育的成熟期,即S6和S7阶段,这意味着ZnT8可能参与了β细胞功能发育成熟的调控。单细胞测序结果表明ZnT8敲除的SC-β细胞中与β功能相关的基因如INS、NKX6.1、PDX1、SYT13、VAMP2等相较于对照组细胞均有显著上调,拟时序分析也表明在分化的最后两个阶段ZnT8缺失的SC-β细胞发育更加成熟。
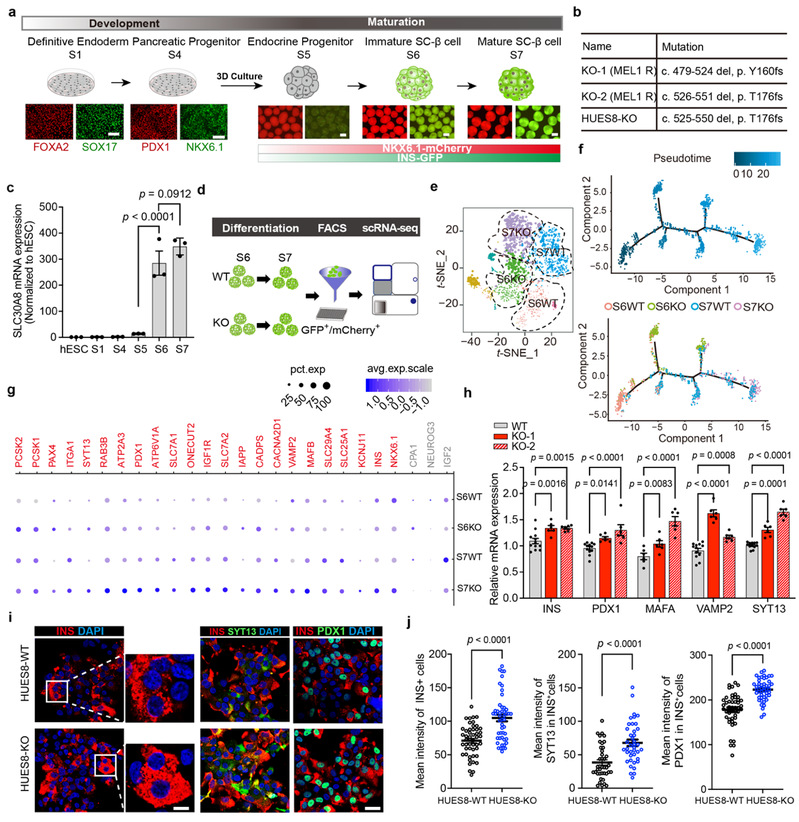
图1,ZnT8缺失促进SC-β细胞功能成熟
葡萄糖刺激胰岛素分泌(Glucose stimulated insulin secretion, GSIS)实验是测试SC-β细胞功能的最佳标准,细胞在高糖刺激下的胰岛素分泌量与低糖刺激下胰岛素分泌量相比的倍数可直接反映β细胞响应糖刺激的能力,倍数越高,能力越强。研究人员为了验证上述结果,在3个独立的ZnT8敲除的细胞系中做了GSIS实验,发现在两轮低糖-高糖刺激下ZnT8缺失的SC-β细胞相较于野生型SC-β细胞均表现出显著的胰岛素分泌能力增强的表型。研究人员通过进一步探索发现,ZnT8缺失的SC-β细胞旺盛的胰岛素分泌能力可能与其解除了锌离子对胰岛素分泌的负反馈抑制相关。
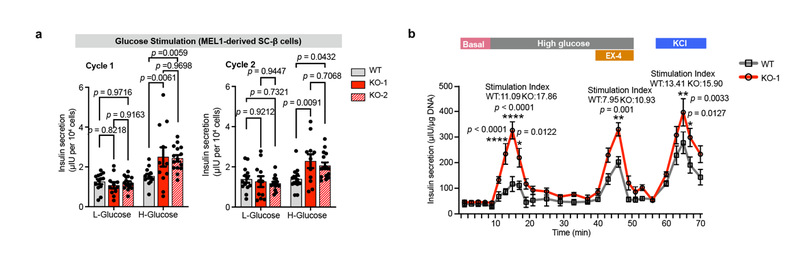
图2,ZnT8功能缺失促进SC-β细胞胰岛素分泌
2.ZnT8功能缺失提高SC-β细胞抵抗代谢压力的能力
该研究发现,ZnT8缺失的SC-β细胞在经棕榈酸等脂毒性诱导物处理后凋亡细胞数量显著少于经相同处理的对照组,这意味着ZnT8缺失的β细胞可以更好得抵抗高脂引起的代谢压力。进一步分析发现,ZnT8缺失的SC-β细胞在一定浓度的棕榈酸的刺激下并未表现出与对照组相同的以IRE1α、sXBP1为代表的内质网应激标志物显著升高的现象,胞质内钙离子水平与线粒体去极化水平也显著低于对照组。上述结果表明ZnT8缺失可以抵抗脂毒性对SC-β细胞造成的内质网应激压力,从而减少细胞凋亡。
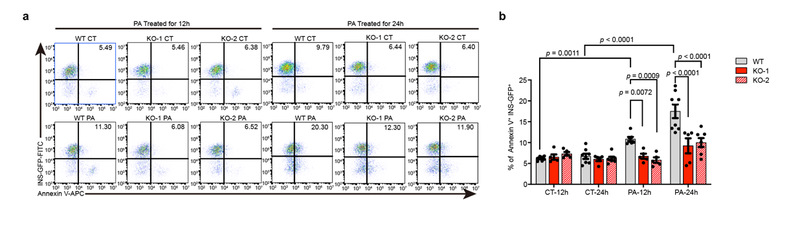
图3,ZnT8功能缺失抑制脂毒性诱导的细胞凋亡
3.ZnT8功能缺失的SC-β细胞可更快改善小鼠糖尿病
研究人员将ZnT8功能缺失的SC-β细胞及其对照组细胞分别移植入使用链脲霉素(Streptozotocin,STZ)建模的SCID-Beige免疫缺陷型小鼠肾包膜内,并在移植后持续监测小鼠血糖变化。研究人员发现,移植了ZnT8功能缺失的SC-β细胞的小鼠在移植一段时间后血糖下降更快,且下降的幅度更大。当血糖下降至180 mg/dL以下时,认为小鼠血糖恢复正常。通过计算治愈率可以发现,移植野生型SC-β细胞的小鼠糖尿病治愈率为42.9%,移植等剂量ZnT8功能缺失的SC-β细胞的小鼠糖尿病治愈率为73.3%,后者比前者治愈率高出了30.4%。经过基因编辑的SC-β细胞相较于未编辑的SC-β细胞可在小鼠体内更加稳定存活。

图4,ZnT8功能缺失的细胞可更快改善小鼠糖尿病
目前,由干细胞诱导分化为β细胞为糖尿病人进行β细胞替代的治疗方法在美国已开展临床实验, Vertex公司临床 phase 1/2期结果显示,移植后第90天,第一位移植患者恢复基础胰岛素生成,每日外源胰岛素需求减少91%;移植第270天,该患者完全脱离外源胰岛素使用。上述临床试验虽取得不错的效果,但所采用的SC-β细胞起效较为缓慢,证明细胞功能本身不成熟,需要依赖内环境进一步发育成熟,且细胞在糖尿病环境中的长期稳定性还有待观察。本研究通过使ZnT8蛋白功能失活成功地增强了β细胞功能并且提高了β细胞抵抗代谢压力的能力,从而在移植后加速了糖尿病小鼠血糖恢复,提高了小鼠糖尿病的治愈率,为优化糖尿病β细胞替代性疗法提供了新靶点、新方法。
李维达教授课题组围绕“糖尿病中β细胞再生”的重大科学问题进行深入研究:构建了高效胰腺转分化系统,提高了胰腺外分泌细胞转分化为胰岛β细胞的效率;通过基因编辑构建了具有抵抗糖尿病病理环境的功能化人类胰岛类器官,在糖尿病动物模型中实现了更高效、更稳定的治疗效果;解析了糖尿病中胰岛β细胞缺损的新机制。相关成果在 Nature Biotechnology、Nature Communications、eLife、Advanced Materials等知名学术期刊发表,并申请了多项发明专利。同时,李维达教授团队与代谢专科、内分泌科等临床科室紧密合作,将此项技术应用于糖尿病干细胞医学的临床转化。
同济大学生命科学与技术学院、同济大学附属东方医院再生医学研究所、教育部“细胞干性与命运编辑”前沿科学中心李维达教授、中国科学院分子细胞科学卓越创新中心程新研究员、瑞典卡罗林斯卡学院邓巧琳教授为论文共同通讯作者,同济大学博士生马青,中国科学院分子细胞科学卓越创新中心博士肖伊妮,同济大学博士生许文君为本文共同第一作者。本工作获得了李维达教授为首席科学家的国家科技部2016重点研发计划干细胞及转化专项青年项目的支持,同时也得到国家自然科学基金、上海市科委重点项目等支持。
参考文献:
1.Ma, Q. et al. ZnT8 loss-of-function accelerates functional maturation of hESC-derived beta cells and resists metabolic stress in diabetes. Nat Commun 13, 4142, doi:10.1038/s41467-022-31829-9 (2022).
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


