Protein Cell|高绍荣团队揭示由扩展多能干细胞(EPS)构建的类胚胎发育缺陷原因并利用EPS细胞产生的双胚层结构结合四倍体滋养外胚层细胞获得可育小鼠
长期以来,由于伦理和技术的限制,对植入阶段胚胎发育及相关疾病的研究进展缓慢。以干细胞为基础的胚胎体外模拟技术为科研人员提供了良好的平台,特别是类囊胚的构建很大程度上允许研究人员对植入前到植入后的连续过程进行操作和观察[1-4]。
2019年Belmonte实验室使用小鼠扩展多潜能干细胞(EPS)构建的“扩展多潜能干细胞类囊胚(EPS-blastoids)”结构就是一种同时包含滋养层(TE)、原始内胚层(PrE)和上胚层(EPI)完整原始三谱系的类囊胚结构[5]。但是遗憾的是EPS-blastoids存在严重的植入后发育缺陷,不能形成有功能的植入后胚胎,这极大的限制了其进一步的应用。
2022年7月15日,同济大学高绍荣课题组在Protein & Cell杂志在线发表题为 “Bilineage embryo-like structure from EPS cells can produce live mice with tetraploid trophectoderm” 的研究论文。该项研究阐述了EPS-blastoids存在植入后发育缺陷的原因和机制,并进一步进行了功能性类囊胚的构建尝试。

研究人员首先对EPS-blastoids进行了谱系特异性基因的检测,发现EPS-blastoids的类滋养层(TE-like)结构中滋养层细胞标记物CDX2的表达量远低于正常囊胚的TE细胞,并且TE-like结构普遍表达PrE谱系的特异性基因GATA6、SOX17和PDGFRα。随后研究人员使用体内移植实验和植入后胚胎体外培养系统(IVC)对EPS-blastoids进行了植入后发育能力的验证。结果显示,在体内移植实验中EPS-blastoids和胚胎干细胞(ES)产生的拟胚体(EBs)一样虽然能够引起蜕膜反应,但是蜕膜内并没有正常的植入后结构。而在体外实验中,大部分EPS-blastoids形成的植入后胚胎样结构包含NANOG+的EPI和SOX17+的脏内胚层(VE)而缺乏TFAP2C+的胚外外胚层(ExE)谱系细胞。以上实验证明了EPS-blastoids中TE-like结构并不是典型TE谱系细胞。
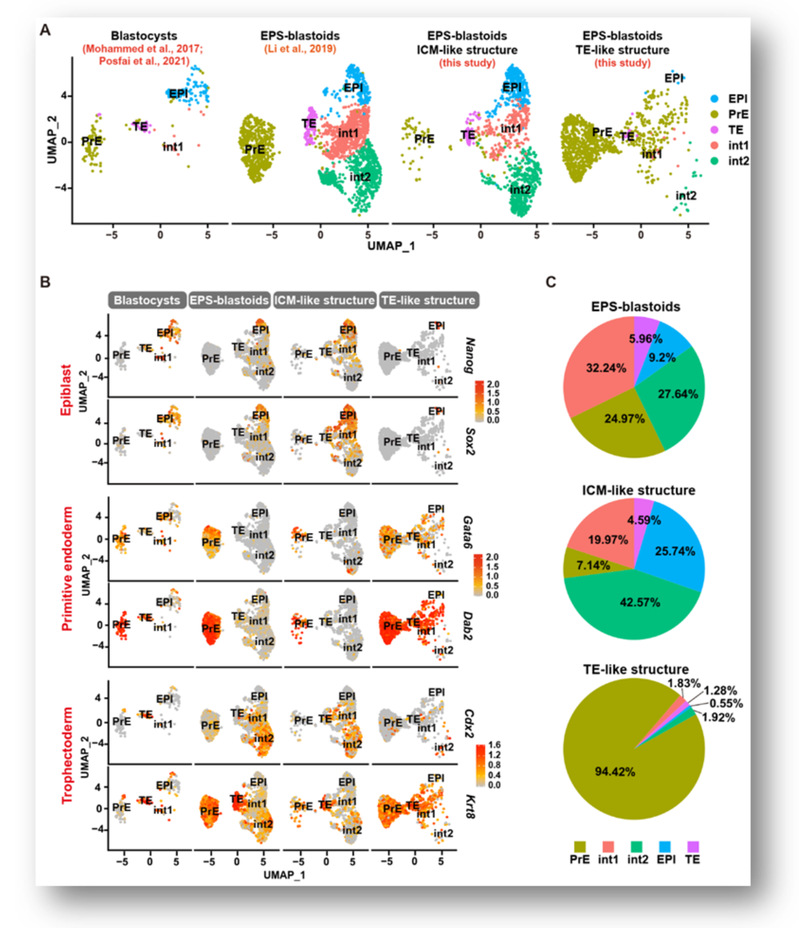
图1.EPS-blastoids中TE-like与ICM-like结构的单细胞数据分析
为了探究EPS-blastoids缺乏TE谱系细胞的原因,研究人员分别对EPS-blastoids的TE-like结构和类内细胞团(ICM-like)结构进行了单细胞测序,结果显示TE-like结构基本上是由PrE谱系细胞(94.42%)构成的,而少量的TE细胞(4.59%)则来自于ICM-like结构(图1)。研究人员在对EPS细胞的扩展多能性进行研究时发现EPS细胞中存在GATA6/SOX17/PDGFRα+OCT4+的PrE-like细胞。通过使用PrE分化培养基处理可以显著的提高EPS甚至是ES细胞形成EPS-blastoids的的效率(图2)。相反,若通过敲除Gata6来阻止EPS细胞向PrE方向分化则会导致EPS-blastoids不能形成。以上实验证实了EPS细胞向PrE谱系细胞分化的倾向是EPS-blastoids形成的重要原因。
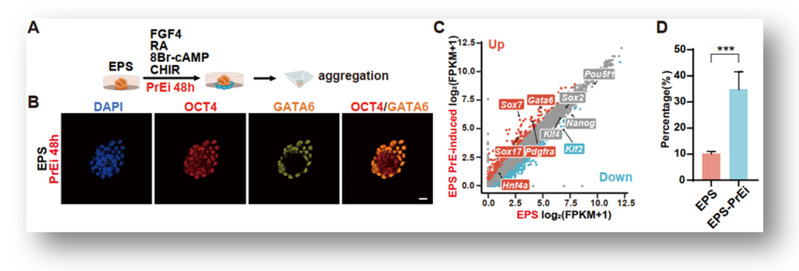
图2. PrE方向的诱导分化可以促进EPS细胞形成EPS-blastoids
功能性的囊胚由滋养层(TE)、上胚层(EPI)和原始内胚层(PrE)三种细胞谱系构成。研究人员发现EPS-blastoids虽然不能产生足够的TE谱系细胞,但是其形成过程中会产生包含PrE和EPI的双胚层结构(Bilineage embryo-like structures,BLES)。由于PrE的缺乏也是类囊胚的构建过程中的主要障碍,因此研究人员试图利用这种BLES结构进行功能性重组胚胎的构建。研究人员将BLES注射到扩张期四倍体囊胚腔中,使四倍体胚胎的TE细胞与BLES进行了重组。这种重构胚胎在移植后成功获得了正常妊娠,其中BLES可以发育为胎儿和卵黄囊,并进一步产生了可育的小鼠。
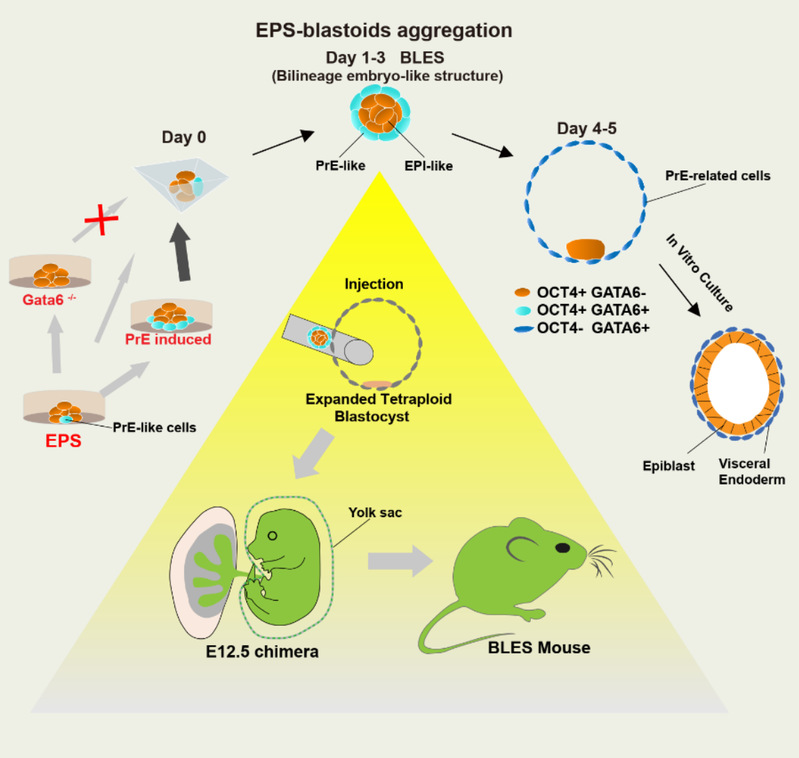
综上所述,研究人员发现EPS-blastoids由于缺乏真正的TE谱系细胞而无法实现植入后发育,其TE-like结构是由PrE谱系细胞构成的。该研究进一步使用包含EPI和PrE谱系细胞的BLES与四倍体胚胎的TE重新构建,实现了可育小鼠的产生。这项研究为功能性类囊胚的建立提供了理论和实验基础。
高绍荣教授实验室的刘奎升博士、徐小翠博士以及柏丹丹博士为本文的共同第一作者。高绍荣教授、刘文强研究员以及王译萱教授为本论文的共同通讯作者。本研究得到科技部、国家自然科学基金委、以及上海市科委等项目的支持。
Rivron N C, Frias-Aldeguer J, Vrij E J, et al. Blastocyst-like structures generated solely from stem cells [J]. Nature, 2018, 557(7703): 106-11.
Harrison S E, Sozen B, Christodoulou N, et al. Assembly of embryonic and extraembryonic stem cells to mimic embryogenesis in vitro [J]. Science, 2017, 356(6334).
Sozen B, Cox A L, De Jonghe J, et al. Self-Organization of Mouse Stem Cells into an Extended Potential Blastoid [J]. Dev Cell, 2019, 51(6): 698-712 e8.
Beccari L, Moris N, Girgin M, et al. Multi-axial self-organization properties of mouse embryonic stem cells into gastruloids [J]. Nature, 2018, 562(7726): 272-6.
Li R, Zhong C, Yu Y, et al. Generation of Blastocyst-like Structures from Mouse Embryonic and Adult Cell Cultures [J]. Cell, 2019, 179(3): 687-702 e18.
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


