毛志勇教授团队建立新的DNA修复检测系统并阐述PARP1-SIRT1-BRG1信号轴在HR修复中的染色质密度调控机制
2019年7月10日,同济大学生命科学与技术学院毛志勇教授课题组在《Nucleic acids research》上在线发表了题为“A PARP1-BRG1-SIRT1 axis promotes HR repair by reducing nucleosome density at DNA damage sites”的文章。该研究建立了一种基于红色和绿色荧光的易于量化的新型DNA双链断裂修复(double strand break repair, DSBR)检测手段;利用该方法,研究团队深入阐述了PARP1-SIRT1-BRG1信号轴在HR修复中的染色质密度调控功能。

DNA双链断裂是对细胞危害最为严重的一类DNA损伤,而DSBR会高效修复这种损伤以求将对细胞的损害降到最低。DSBR可主要分为两大类,一类依靠姐妹染色单体上的同源序列指导修复的精确进行,称为同源重组(Homologous recombination, HR);而另一类则直接将断裂末端相连,往往造成DNA片段的插入或缺失,称为非同源末端连接(Non-homologous end joining, NHEJ)。这两条通路的修复效率以及通路间的选择与平衡伴随着机体的生长发育以及多种疾病的发生发展不断动态变化,因此准确定量地分析染色质特定位点的HR与NHEJ效率及其之间的选择与平衡有利于人们从基因组稳定性的角度更深入地理解生、老、病、死的生物学过程。
为发展一种新型的检测手段以同时分析两条通路的相互关系,团队基于绿色荧光蛋白GFP与红色荧光蛋白tdTomato构建了一种双报告载体并将其整合至细胞系中。在通过外源转入内切酶I-SceI从而诱导载体发生定点双链断裂后,成功通过HR修复损伤的细胞会发出红色荧光,而通过NHEJ完成修复的细胞则会发出绿色荧光。利用流式细胞技术,研究者便可同时定量分析成功发生HR或NHEJ修复的细胞比例,并得知细胞修复该位点损伤时在这两种修复方式中选择的偏好性。
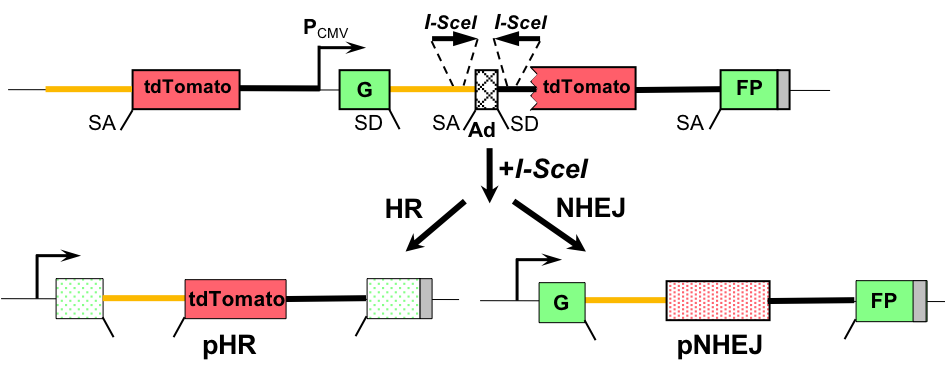

接着,研究团队将该报告载体整合至染色质不同位点建立了若干不同的细胞克隆。通过修复效率分析发现不同位点的HR效率存在着近72.6倍的巨大差异。进一步研究表明,这些位点的核小体密度与HR效率、HR/NHEJ偏好性均存在显著负相关。此外,损伤发生后,断裂位点邻近区域的核小体密度也显著降低。这些结果提示较为松散的染色质环境有利于HR修复的进行。
后续一系列机制研究表明:损伤发生后,多聚ADP核糖聚合酶PARP1催化产生的多聚ADP核糖链会通过与去乙酰化酶SIRT1的ZNF结构域及与ATP依赖的染色质重塑因子BRG1的ATPase结构域分别发生相互作用,从而招募其到达损伤位点。在损伤处,SIRT1对BRG1的1029及1033位赖氨酸进行去乙酰化从而增强其ATPase活性,促进其松散损伤位点附近的核小体结构,进而有利于HR相关因子RPA2及RAD51招募,最终推动HR修复的进行。
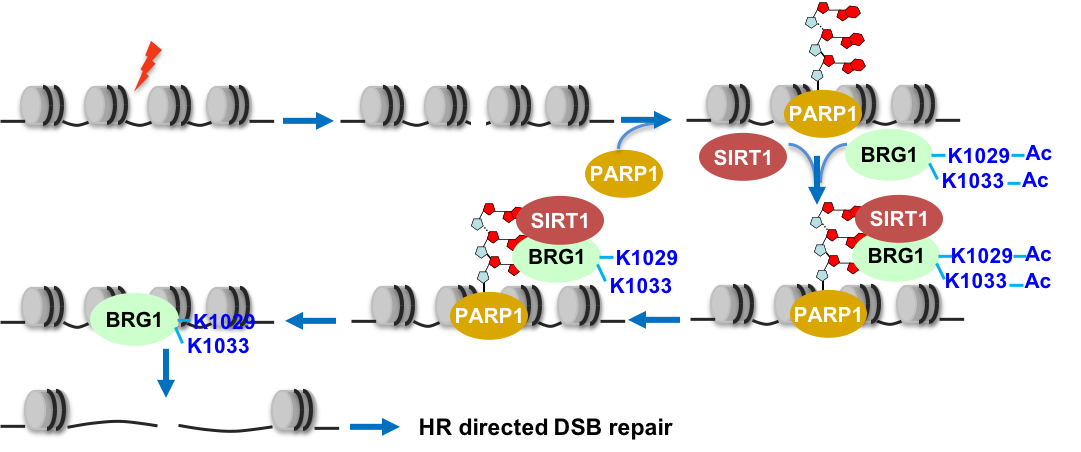
毛志勇教授课题组长期致力于衰老及相关疾病如肿瘤相关的DNA损伤修复的研究工作。本次发表的研究成果是基于团队前期参与开发的HR或NHEJ单报告载体进行的改进与升级,该工具为今后研究者精确研究胞内DNA双链断裂修复变化及调控机制提供了全新的选择。此外,该工作通过阐述HR修复过程中PARP1-SIRT1-BRG1信号轴对核小体密度的调控作用,提示PARP1在HR修复中亦扮演重要角色,预示着PARP1抑制剂在HR通路激活的肿瘤类型的治疗中也存在潜在的重要应用价值。
同济大学生命科学与技术学院博士研究生陈御、张海萍及许柱为本文的共同第一作者。同济大学生命科学与技术学院毛志勇教授、蒋颖副研究员及罗彻斯特大学Vera Gorbunova教授为本文的共同通讯作者。毛志勇课题组的博士研究生唐欢胤、耿安珂、蔡白莲、苏涛,江赐忠教授课题组的史偈君博士及罗彻斯特大学田骁博士也参与了相关研究。该工作同时得到了同济大学江赐忠教授、浙江大学黄俊教授、同济大学附属第一妇婴保健院万小平教授及罗彻斯特大学Andrei Seluanov教授的支持。该研究成果得到国家重点研发计划、优秀青年科学基金、国家自然科学基金面上项目及上海市优秀学术带头人计划等经费的资助。
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


