沈沁教授团队揭示转录因子ZEB1在发育的大脑新皮层中的功能和作用机制
哺乳动物的大脑新皮层,由神经管最前端的背侧面发育而来,是一个高级组织化的六层结构,几乎掌管了所有的高级认知功能(1)。大脑新皮层六层结构的形成涉及到神经干细胞和前体细胞的增殖和各种神经元的分化,以及神经元的迁移等多个生物学过程。若在发育过程中神经元迁移被扰乱,就会影响神经网络的正确链接,引发严重的神经迁移障碍,导致严重的神经系统疾病,如自闭症和无脑回畸形(2-4)。因此,研究大脑新皮层的发育和神经元迁移的机制有着重要的临床意义。锌指E-盒结合同源盒蛋白1 (Zeb1)是大家熟知的上皮细胞-间质转型和肿瘤转移的关键调控因子。ZEB1的突变与人类遗传性眼疾和大脑发育缺陷相关联。此外,在脑瘤和很多其他类型的肿瘤中ZEB1的表达水平显著增高(5-7)。然而,我们对它在大脑发育中的作用却知之甚少。
2019年5月21日,同济大学生命科学与技术学院沈沁团队在Cell Reports杂志上发表长文ZEB1 represses neural differentiation and cooperates with CTBP2 to dynamically regulate cell migration during neocortex development,全面地研究了ZEB1在胚胎大脑新皮层中神经干细胞及前体细胞分化和神经细胞迁移中的调控作用及相关的分子机制。

首先研究人员通过在小鼠和人的胚胎大脑切片中染色确定了ZEB1蛋白表达位置和细胞类型:在小鼠及人的大脑皮层发育阶段,Zeb1在神经生发区即脑室区和脑室下区的神经前体细胞中特异性表达,而在神经前体细胞分化形成的神经元中不再表达。
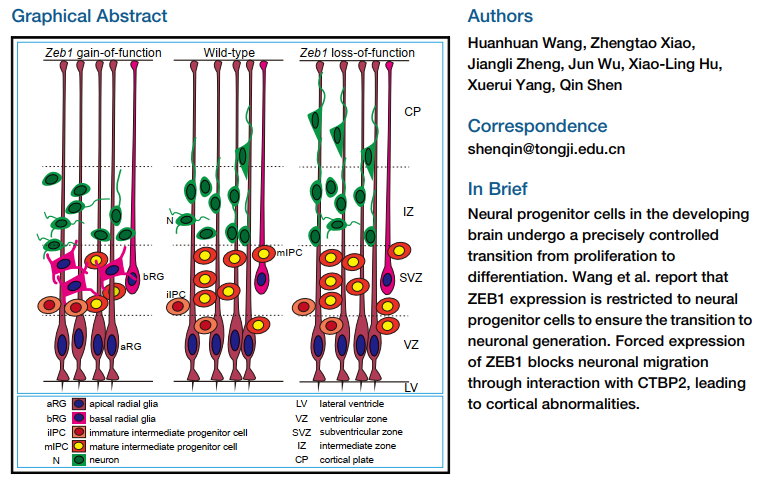
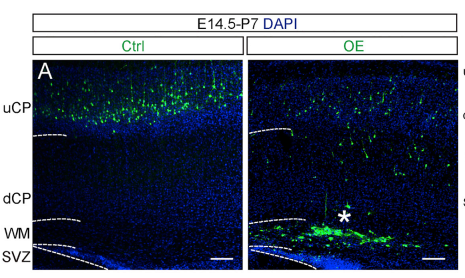
之后,通过子宫内胚胎电转这一可以在特定时间和区域改变基因表达的技术,研究人员发现操纵(敲减或过表达)Zeb1在小鼠胚胎大脑皮层细胞中的表达水平会影响正常的神经分化和迁移过程。更为显著的是,过表达Zeb1不改变神经前体细胞的增殖却改变了它们的分布和分化。这些过程伴随着神经分化转录因子—Neurod1的下调和滞后的多极性-双极性转变。持续地过表达Zeb1最终导致出生后的小鼠中出现严重的神经细胞迁移缺陷,这些未迁移细胞在胼胝体位置形成异位带(heterotopia),类似人类大脑疾病(如癫痫、阅读障碍、无脑回畸形)的异位带特征。
通过高通量的RNA-seq和ChIP-seq,研究人员发现ZEB1调控一系列参与细胞分化和迁移的基因,如Neurod1, Unc5d, Gsn, Lmcd1。通过IP-MS的技术,研究人员在胚胎小鼠皮层组织里筛选ZEB1蛋白的互作蛋白,最终通过体内免疫共沉淀验证了ZEB1与CTBP2的相互结合。研究发现,与Zeb1相似,过表达Ctbp2会影响细胞极性转变并抑制神经元的迁移。此外,通过构建与CTBP2蛋白弱/不相互作用的ZEB1突变体并胚胎电转,进一步确定了ZEB1蛋白调控细胞极性转变依赖于它与CTBP2的结合,而抑制Neurod1表达不依赖这个相互作用。
这项工作揭示了在大脑新皮层神经前体细胞的发育进程中需要及时下调Zeb1的表达来保证正确的神经分化和细胞定位,也进而表明Zeb1的动态表达对于正常的皮层发育是至关重要的,并提示在大脑发育过程中ZEB1存在不依赖于EMT相关分子的作用机制。这些发现有助于理解神经分化时复杂的转录调控机制。
该工作第一作者是清华大学生命科学学院CLS项目博士生王欢欢,通讯作者为同济大学生命科学与技术学院沈沁教授。清华大学生命科学学院杨雪瑞教授及其学生肖正涛(现为杜克大学博士后)负责论文中高通量数据分析,清华大学医学院博士生郑江莉、武君和首都医科大学基础医学院胡晓玲博士在实验方面给予了大力支持。
1. Marin, O., and Rubenstein, J.L. (2002). Patterning, Regionalization, and Cell Differentiation in the Forebrain. In Mouse Development Patterning, Morphogenesis, and Organogenesis, P.P.L.T. Janet Rossant, ed. (San Diego: Academic Press), pp. 75-106.
2. Gleeson, J.G., and Walsh, C.A. (2000). Neuronal migration disorders: from genetic diseases to developmental mechanisms. Trends Neurosci 23, 352-359.
3. Guerrini, R., and Parrini, E. (2010). Neuronal migration disorders. Neurobiol Dis 38, 154-166.
4. Copp, A.J., and Harding, B.N. (1999). Neuronal migration disorders in humans and in mouse models--an overview. Epilepsy Res 36, 133-141.
5. Kahlert, U.D., Suwala, A.K., Raabe, E.H., Siebzehnrubl, F.A., Suarez, M.J., Orr, B.A., Bar, E.E.,
Maciaczyk, J., and Eberhart, C.G. (2015). ZEB1 Promotes Invasion in Human Fetal Neural Stem Cells and Hypoxic Glioma Neurospheres. Brain Pathol 25, 724-732.
6. Siebzehnrubl, F.A., Silver, D.J., Tugertimur, B., Deleyrolle, L.P., Siebzehnrubl, D., Sarkisian, M.R., Devers, K.G., Yachnis, A.T., Kupper, M.D., Neal, D., et al. (2013). The ZEB1 pathway links
glioblastoma initiation, invasion and chemoresistance. EMBO Mol Med 5, 1196-1212.
7. Singh, S., Howell, D., Trivedi, N., Kesslee, K., Ong, T., Rosmaninho, P., Raposo, A.A.S.F., Robinson, G., Roussel, M.F., Castro, D.S., et al. (2016a). Zeb1 controls neuron differentiation and germinal zone exit by a mesenchymal-epithelial-like transition. Elife 5.
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


