Nature Cell Biology | 高绍荣/高亚威团队揭示小鼠早期胚胎母源-合子转变过程中RNA m6A修饰动态变化与作用机制
早期胚胎发育最初阶段是卵母细胞通过受精作用形成受精卵。受精作用触发卵母细胞中存储的RNA与蛋白质等物质将被降解(maternal decay),而合子基因组被激活(zygotic genome activation, ZGA),这一过程也被称为母源-合子转变(maternal-to-zygotic transition, MZT)过程。母源-合子转变过程中存在蛋白质组、组蛋白表观修饰组、DNA甲基化组和转录组等多层级的重编程。其中转录组随着单细胞测序技术的发展,近年取了很多重要成果1,但RNA调控机制上依然存在大量研究空白。
N6-甲基腺嘌呤(m6A)是真核生物mRNA上丰度最高的修饰,被认为广泛参与RNA的剪接、转运、降解、翻译、以及相分离等过程的调控,在配子发生和胚胎发育中发挥重要的调控作用。METTL3和METTL14是最经典的m6A甲基转移酶,在细胞系中敲降Mettl3会降低大部分位点的m6A甲基化水平,导致胚胎干细胞分化障碍和胚胎植入后发育阻滞,METTL14的缺失也会造成类似的结果2。METTL16也具有m6A甲基转移酶活性,METT16的缺失导致植入后胚胎发育的阻滞3。甲基转移酶复合体中还有一些蛋白如WTAP、ZC3H13、KIAA1429/VIRMA都对METTL3/METTL14具有重要的调控活性2。其中,沈彬团队和合作者前期发现KIAA1429在卵母细胞中高表达,其缺失会引起GV阶段卵母细胞中m6A修饰剧烈降低,卵子发育阻滞4。综上所述,m6A的写入对小鼠卵母细胞成熟、早期胚胎以及植入后胚胎发育都具有重要作用。由于小鼠早期胚胎只含有微量RNA,无法满足传统m6A测序技术需要至少2 μg总RNA的要求,目前还没有研究从组学水平解析m6A修饰在早期胚胎发育中的动态变化并揭示其作用机制。
2022年5月23日,同济大学生命科学与技术学院高绍荣/高亚威教授团队与南京医科大学生殖医学国家重点实验室沈彬教授团队合作在Nature Cell Biology在线发表了题为N6-methyladenosine regulates maternal RNA maintenance in oocytes and timely RNA decay during mouse maternal-to-zygotic transition(RNA甲基化修饰m6A调控母源-合子转变过程中RNA的维持和及时降解)的研究论文,首次报道了小鼠早期胚胎母源-合子转变过程中RNA m6A修饰的动态变化图谱,并揭示了m6A调控母源RNA稳定性和2-细胞短暂表达RNA降解的作用机制。

在这项研究工作中,为揭示m6A在小鼠早期胚胎中的位置分布,研究人员首先优化了传统的m6A测序方法,开发了适用于50 ng 总RNA起始的ULI-MeRIP-seq方法,该方法能够精确富集出m6A修饰的转录本,与大量RNA起始所获得的m6A转录本信息高度重叠。随后,研究人员分别对小鼠的GV、MII卵母细胞和受精后的胚胎(1-,2-,4-细胞)进行了m6A修饰的检测,获得了mRNA和非编码RNA上m6A的分布情况。在卵母细胞中,约40%的后续会被降解的mRNA(maternal decay, MD)上具有m6A修饰的富集,包括一些与卵子发育调控相关的转录本,这些转录本在卵母细胞中丰度相对更高,并大多在受精后才被降解。而在ZGA转录本中,约70%都富集m6A修饰,其中包括2-细胞特异性表达的RNA如Zscan4(图1)。

图1. m6A 在母源-合子转变过程中的分布与富集
此外,研究人员首次发现在非编码的转录本中有大量m6A修饰存在于转座子RNA上。其中,卵母细胞中高丰度转座子元件MTA(属于MaLR家族)转录本上m6A高度富集。而在受精后,2-细胞特异性表达的MERVL(属于ERVL家族)转座子同样高度富集了m6A修饰。之前的报道发现MTA转录本在GV阶段的缺乏,会引发GV发育的阻滞,而MERVL的激活被认为对于ZGA的正常发生具有重要作用。因此MZT过程中逆转座子RNA的调控非常重要,而这些RNA上的m6A修饰可能在其中扮演重要角色。
为了揭示m6A对于母源转录本的调控作用,研究人员利用了卵母细胞特异性敲除Kiaa429(RNA甲基转移酶复合体成员之一)的小鼠,通过ULI-MeRIP-seq检测其GV阶段的卵子中的m6A分布,发现m6A水平明显降低,与此同时,那些本身富集m6A的转录本的丰度也显著降低,其中母源转座子MTA的m6A及RNA水平均剧烈下降(图2),而其他研究显示MTA的转录本水平降低也会直接影响到卵子正常发育5。由此说明,KIAA1429作为甲基转移酶中的关键因子,在卵中帮助了mRNA及转座子MTA上m6A的维持,且这些m6A修饰对于RNA本身的稳定性具有重要维持作用。
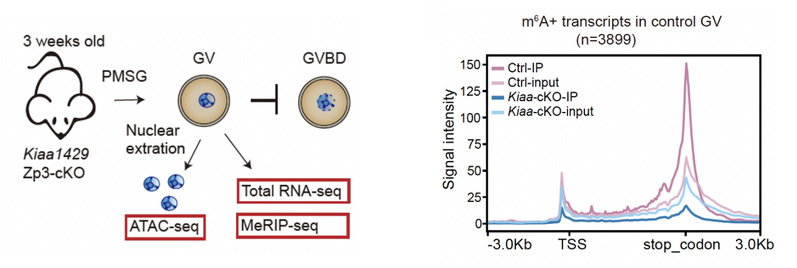
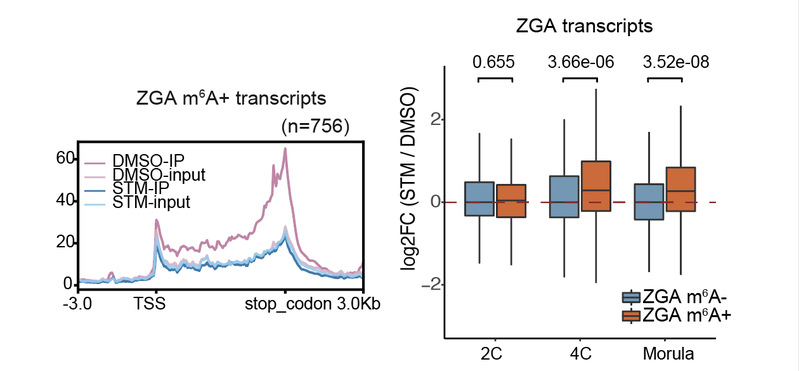
图2. KIAA1429母源特异性敲除卵母细胞及METTL3抑制剂处理胚胎的m6A修饰
为研究m6A对受精后ZGA相关转录本的调控,研究团队建立了甲基转移酶敲降系统,发现ZGA中一些2-细胞特异性转录本出现上调与降解障碍。随后研究人员利用甲基转移酶METTL3抑制剂STM24576阻断了包括母源和合子METTL3蛋白的甲基转移酶活性,发现METTL3催化功能缺失会引发胚胎发育阻滞,主要体现为4-细胞退出延迟与囊胚发育率下降。对于2-细胞样品进行转录组与m6A修饰分布检测,结果发现STM2457能够有效抑制ZGA转录本上m6A的建立(图2)。重要的是研究人员发现抑制剂处理并没有影响2-细胞时期转录本水平,但是在胚胎发育至桑椹胚的过程中,一些短暂表达的ZGA转录本如Zscan4,逆转座子MERVL等,其RNA丰度下降过程被延迟,说明m6A对一些2-4-细胞时期短暂表达的转录本的及时降解具有调控作用。而这些阶段特异性转录本的降解异常,可能是导致胚胎发育延迟的重要原因。
综上所述,此项工作利用ULI-MeRIP-seq首次绘制了小鼠早期胚胎发育过程中转录本上m6A修饰的动态图谱,并证实了母源的转座子MTA和2-细胞时期转座子MERVL具有高度的m6A修饰富集。研究进一步发现m6A修饰分别维持了卵母细胞中母源RNA的稳定性,以及受精后短暂表达的转录本的及时降解。m6A修饰在卵母细胞和合子基因激活阶段不同的调控功能体现了生命初始阶段调控的复杂性,并为进一步探究生命调控奥秘开辟了全新视角。
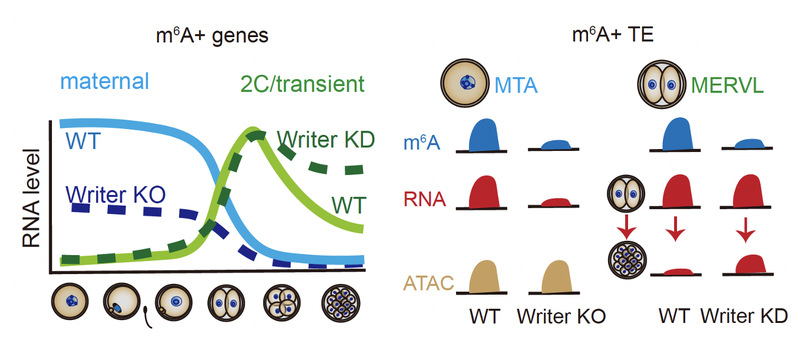
图3. m6A调控小鼠母源-合子转变模式图
本项目由同济大学高绍荣/高亚威团队以及南京医科大学沈彬团队合作完成。第一作者是同济大学博士后吴悠,徐小翠,以及南京医科大学齐美杰博士。高绍荣教授,高亚威教授与沈彬教授是本文的共同通讯作者。浙江大学附属妇产科医院的陈川博士,北京大学伊成器教授,芝加哥大学向俊鸿博士,山东大学生殖医学研究中心的刘洪彬教授也参与了此项工作。该研究得到了科技部、国家自然科学基金委、以及上海市科委等项目的支持。
研究团队致力于解析小鼠早期胚胎及植入后胚胎发育以及胚胎干细胞中的m6A调控作用,近期阐明了FTO基因通过调控LINE1 RNA的m6A修饰调控核表观与发育7,YTHDC1调控早期胚胎及胚胎干细胞中LINE1 RNA功能8等多项重要机制。当前微量测序技术的改进对于发育过程中m6A调控作用的研究提供了重要的技术保障。
Sha, Q. Q., Zhang, J. & Fan, H. Y. A story of birth and death: mRNA translation and clearance at the onset of maternal-to-zygotic transition in mammalsdagger. Biol Reprod 101, 579-590, doi:10.1093/biolre/ioz012 (2019).
Frye, M., Harada, B. T., Behm, M. & He, C. RNA modifications modulate gene expression during development. Science 361, 1346-1349, doi:10.1126/science.aau1646 (2018).
Mendel, M. et al. Methylation of Structured RNA by the m(6)A Writer METTL16 Is Essential for Mouse Embryonic Development. Mol Cell 71, 986-1000 e1011, doi:10.1016/j.molcel.2018.08.004 (2018).
Hu, Y. et al. Oocyte competence is maintained by m(6)A methyltransferase KIAA1429-mediated RNA metabolism during mouse follicular development. Cell Death Differ 27, 2468-2483, doi:10.1038/s41418-020-0516-1 (2020).
Park, C. E. et al. Oocyte-selective expression of MT transposon-like element, clone MTi7 and its role in oocyte maturation and embryo development. Mol Reprod Dev 69, 365-374, doi:10.1002/mrd.20179 (2004).
Yankova, E. et al. Small-molecule inhibition of METTL3 as a strategy against myeloid leukaemia. Nature 593, 597-601, doi:10.1038/s41586-021-03536-w (2021).
Wei, J. et al. FTO mediates LINE1 m(6)A demethylation and chromatin regulation in mESCs and mouse development. Science, eabe9582, doi:10.1126/science.abe9582 (2022).
Chen, C. et al. Nuclear m(6)A reader YTHDC1 regulates the scaffold function of LINE1 RNA in mouse ESCs and early embryos. Protein Cell 12, 455-474, doi:10.1007/s13238-021-00837-8 (2021).
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


