汪世龙教授课题组在《ACS Applied Materials & Interfaces》发表论文揭示纳米材料LDH协同miRNA促进成骨的作用和分子机制
2021年10月7日,汪世龙教授课题组在《ACS Applied Materials & Interfaces》杂志上在线发表题为“Layered Double Hydroxide Nanoparticles with Osteogenic Effects as miRNA Carriers to Synergistically Promote Osteogenesis of MSCs”的研究论文。该研究阐释了纳米材料LDH搭载miRNA let-7d协同促进大鼠骨髓间充质干细胞(rBMSCs)成骨分化的作用和机制,并构建负载LDH/let-7d的纤维蛋白支架,通过体外实验及裸鼠皮下异位成骨模型评价其成骨效果。
间充质干细胞(MSCs)因其具有多向分化潜能及较低的免疫原性,是骨组织工程中理想的种子细胞,但如何在体内外调控其高效定向分化仍然是当今的研究热点之一。大量研究显示,miRNA在成骨分化调控中发挥重要作用,使用外源性人工合成的miRNA导入细胞可作为一种强大的基因调节手段。然而,无载体负载的游离miRNA难以有效递送至目的细胞,因而迫切需要高效、安全的载体。纳米材料LDH具有良好的生物相容性及阴离子交换特性,是理想的非病毒核酸载体。本研究发现LDH自身可显著促进rBMSCs的成骨分化,上调成骨相关基因表达水平并增强碱性磷酸酶活性。同时,LDH可有效搭载具有成骨诱导效果的miRNA let-7d进入细胞,进一步提高成骨分化水平。此外,为促进LDH/let-7d纳米复合物的体内应用,本研究构建了LDH/let-7d修饰的纤维蛋白支架,证实其在体外及裸鼠皮下异位成骨模型中均具有一定的成骨诱导能力。利用转录组测序进行机制分析,发现LGR5/β-catenin和IKK/NF-κB信号通路可能在LDH介导的成骨分化中起重要作用。通过siRNA敲降LGR5可抑制LDH引起的β-catenin核转位与细胞成骨分化。同时,LDH可抑制脂多糖(LPS)诱导的NF-κB激活,提高炎症条件下细胞的成骨分化水平,提示LDH可能具有减轻炎症反应和促进骨再生修复的双重作用,有望应用于炎症性骨病的治疗。该研究为纳米材料LDH在骨组织工程中的应用提供了新思路。
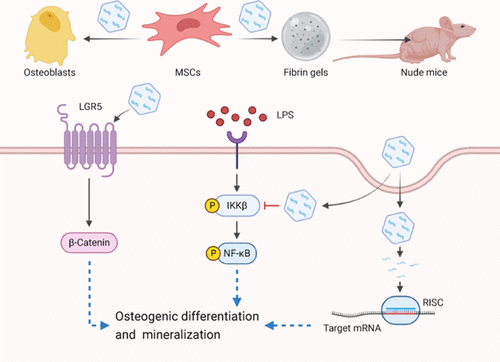
LDH/let-7d促进rBMSCs成骨分化的机制示意图
同济大学生命科学与技术学院和东方医院转化医学研究中心汪世龙教授与上海市宝山区中西医结合医院钱叶长教授为本文的共同通讯作者。博士生杨荔为该工作的第一作者。本课题得到了国家重点研究开发项目、国家自然基金和上海市自然科学基金的资助。
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


