同济大学戈宝学/毛志勇教授团队在《Nature》发表论文揭示胞内DNA识别受体cGAS核内全新...
10月24日,我校附属肺科医院/医学院戈宝学课题组和生命科学与技术学院/附属第一妇婴保健院毛志勇课题组在国际权威学术期刊Nature在线发表题为“Nuclear cGAS suppresses DNA repair and promotes tumorigenesis”的论文。该研究发现,胞浆DNA识别受体cGAS在细胞发生DNA损伤时可转位进入细胞核,并被招募至DNA损伤位点,通过干扰PAPR1/Timeless复合体形成,抑制DNA同源重组修复(Homologous Recombination Repair),进而降低基因组稳定性,最终促进肿瘤的发生。该工作首次系统阐释了cGAS完全独立于DNA识别的核内功能,同时,为基于干预cGAS入核开发新型抗肿瘤药物奠定了理论基础。
2013年,美国科学院院士陈志坚(Zhijian James Chen)教授首次鉴定出胞浆DNA识别受体环鸟苷酸-腺苷酸合成酶(cyclic GMP-AMP synthase,cGAS),这在DNA识别领域具有里程碑意义。cGAS能够识别细胞质内的双链DNA (dsDNA),包括外源dsDNA(如病毒、细菌、寄生虫等)和自身dsDNA(如受损的线粒体DNA、微核DNA、反转录转座子等)。cGAS和dsDNA结合后催化形成第二信使—环鸟苷酸-腺苷酸,产生的环鸟苷酸-腺苷酸会结合和激活下游干扰素刺激蛋白STING,进而招募丝氨酸苏氨酸蛋白激酶TBK1,并激活转录因子IRF3,最终导致I型干扰素和相关免疫因子的产生。近年来,关于cGAS识别dsDNA并诱导下游信号通路激活及I型干扰素生成方面成果不断涌现。然而,值得注意的,在进化上,cGAS的出现先于其调控的I型干扰素,其是否发挥DNA识别介导I型干扰素这一经典功能之外的、“不为人知”的作用呢?
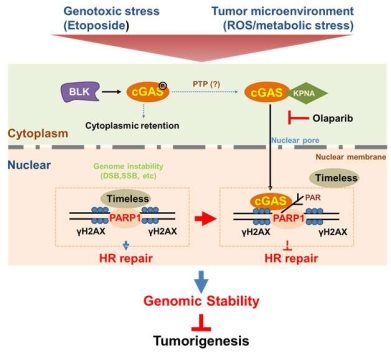
研究者首先通过核质分离实验和免疫荧光实验发现在DNA损伤(etoposide,camptothecin和H2O2处理)压力下,大量cGAS快速进入到细胞核内。而且,cGAS的DNA识别能力和酶活性并不参与其入核调控。有趣的是,cGAS的Y215E突变体在DNA损伤压力下并不能入核。通过制备Y215酪氨酸位点磷酸化抗体,研究者进一步发现,在DNA损伤压力下cGAS的215酪氨酸位点磷酸化水平显著下降,说明cGAS Y215的磷酸化对于cGAS胞浆滞留十分重要。研究者进一步筛选了89个酪氨酸激酶shRNA对GFP-cGAS入核的调控作用,发现下调BLK(B-lymphoid tyrosine kinase)表达可显著增强cGAS入核,同时cGAS Y215位点的磷酸化水平降低。研究提示, BLK可促进cGAS Y215位点磷酸化使其在细胞质中滞留。此外,研究者发现cGAS存在一个保守的核定微信号序列(Nuclear Localization Sequence, NLS),可通过与importin α相互作用调控其转位入核。该研究首次证明cGAS入核是一个受调控的过程。
相较肿瘤细胞,稳定的基因组是健康细胞的重要标记。但是组成基因组的DNA却可受多种内外源因素影响,如该研究中所使用的数个化合物均可造成DNA损伤,若修复DNA损伤的通路出现紊乱,则基因组完整性会被破坏,促发肿瘤的发生。DNA双链断裂是所有DNA损伤中最为严重的一种,细胞应对DNA双链断裂主要有两条修复通路,一条是精确的同源重组(Homologous recombination,HR)修复,另一条是不精确的非同源末端连接(Nonhomologous end joining,NHEJ)修复。HR修复通路出现紊乱时可导致数个器官肿瘤发生概率大大提高,如HR重要调控基因BRCA1/BRCA2出现突变时常导致家族性乳腺癌、卵巢癌等癌症的发生。为了探究cGAS是否参与到DNA损伤修复,研究者首先采用多种手段证明了cGAS能够直接到达DNA双链损伤位点,接着通过体内和体外实验证明了cGAS和γH2AX的相互作用。运用报告载体对其HR和NHEJ效率进行检测,过表达cGAS能够抑制HR修复而对NHEJ修复却没有影响。类似的,cGAS敲除之后会促进HR修复,且并非通过影响细胞周期发挥作用。研究者同时检测了HR修复通路中的重要蛋白RAD51和RPA2的招募,发现过表达cGAS确实能够减弱这两个蛋白的招募。特别值得一提的是,cGAS对HR修复的抑制作用并不依赖于IFN-β以及cGAS的DNA识别功能,提示cGAS对HR的抑制作用是一条完全独立于其DNA识别功能的通路。
为了探究cGAS抑制HR修复的机制,通过质谱分析,研究者们把目标聚焦到了聚腺苷酸二磷酸核糖转移酶-1[poly(ADP-ribose)polymerase-1,PARP-1]上。PARP1是存在于真核细胞中催化聚ADP核糖化的细胞核酶,在DNA修复过程中发挥重要作用。PARP抑制剂是第一种成功利用合成致死 (Synthetic Lethality) 概念获得批准在临床使用的靶向DNA修复的抗癌药物。后续的co-IP实验也进一步验证了cGAS和PARP1存在于同一复合体中。体外实验证明cGAS与PARP1没有直接的相互作用,而是PAR介导其互作,并进一步通过阻碍Timeless和PARP1复合体的形成而抑制HR修复。
HR修复常常和肿瘤的形成密切相关,为了探究cGAS对HR修复的这种抑制作用对肿瘤细胞的增殖的影响,研究者们分别在LLC细胞(一种小鼠的肺癌细胞)敲降cGAS观察细胞的增殖情况,发现cGAS敲降可显著降低细胞的增殖能力。同样,在PC9细胞里过表达cGAS能够促进细胞的增殖。体内的小鼠成瘤实验也进一步证明cGAS能够促进肿瘤细胞的增殖。同时,研究者们用软琼脂克隆形成实验检测了cGAS能够促进正常细胞的成瘤性,即cGAS通过抑制细胞的HR修复使得基因组不稳定性增加,进而增加肿瘤生成的风险。
总之,文章发现了cGAS一个全新的功能—即能够抑制HR修复和促进肿瘤的形成。以往对cGAS的认识都是集中在免疫上,即cGAS作为一个DNA受体,能够对外界病原微生物以及胞质内自身的DNA进行识别并激发免疫系统对其进行清除,对其的生理过程研究也只是在胞质内,包括其对破裂的微核进行识别,而cGAS在DNA损伤压力下能够进入到细胞核内并直接到达DNA损伤位点并参与DNA双链断裂损伤修复还是首次被发现,因此这篇文章也将cGAS的功能推向了一个崭新的领域。
同济大学附属肺科医院刘海鹏副研究员、生命科学与技术学院博士研究生张海萍以及医学院博士研究生吴向阳为本文的共同第一作者。戈宝学教授以及毛志勇教授为本文的共同通讯作者。研究工作同时得到复旦大学、湘雅医学院、德国马普感染生物学研究所等研究团队支持。研究由科技部、国家自然科学基金委以及上海市科委等资助。
Copyright© 2011-2015 生命科学与技术学院, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


